Kemi elev
Vad är en Koordinatkovalent bindning?
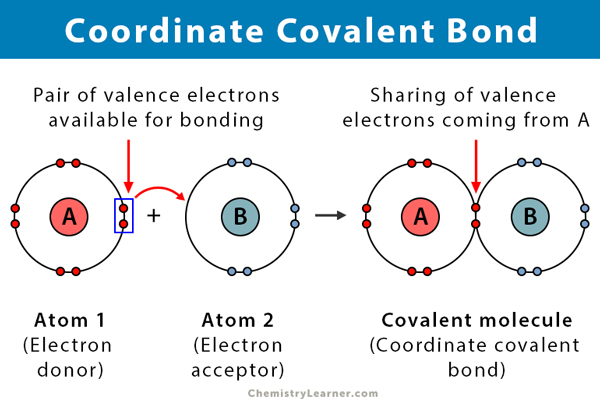
en kovalent bindning bildas när två atomer delar elektroner. En koordinatkovalent bindning, även känd som en dativ kovalent bindning, är en typ av kovalent bindning där det delade paret elektroner kommer från en av atomerna. Atomerna hålls ihop eftersom båda kärnorna lockar elektronparet. När den kovalenta bindningen bildas är det omöjligt att skilja elektronernas ursprung. Denna typ av bindning observeras vanligtvis vid bindning av metalljoner till ligander. Icke-metaller kan dock också delta i denna bindning. Reaktionen mellan Lewis syra och bas är en koordinatkovalent bindning .
en komplex Jon är gjord av två saker, en metalljon och föreningar som kallas ligander. Ligander är neutrala molekyler eller joner som innehåller ensamma elektronpar som kan binda med metalljonen. Vanliga ligander är ammoniak (NH3), vatten (H2O) och halidjoner (Cl–, Br–). Ligander anses Lewis baser eftersom de delar sina elektronpar med metalljonen. Metalljoner är alltid positiva, så de är ganska attraktiva för ensamma elektronpar.
fakta och egenskaper hos Koordinatkovalent bindning
koordinatkovalent bindning har många likheter med den för kovalent bindning. Här är några av dess egenskaper:
- sker mellan en elektrondonator och en elektronacceptor, vanligtvis mellan en metall och en ligand
- sker mellan olika atomer
- bildad genom delning av elektroner donerade av en av atomerna
- styv och riktad
- Polar
- atomer följer oktetregeln
- atomen som donerar elektronerna kallas en givare, och atomen som accepterar dem kallas en acceptor.
- föreningar är sparsamt lösliga i vatten
exempel på Koordinatkovalent bindning
Här är några exempel på molekyler där koordinatkovalent bindning existerar .
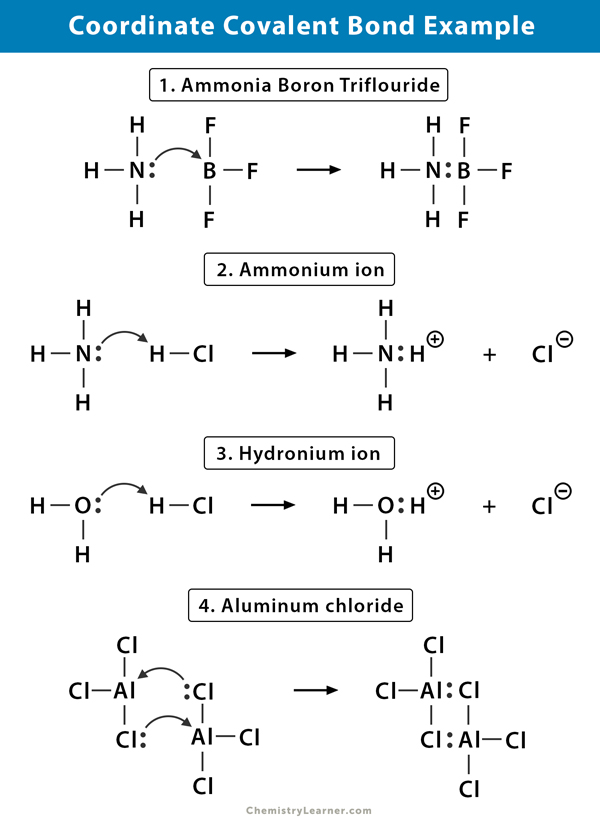
Ammonium (NH4+) Jon
ammoniumjonen bildas från reaktionen av ammoniak (NH3) gas med väteklorid (HCl) gas. I NH4+ är det fjärde väte fäst med en koordinatkovalent bindning eftersom endast vätekärnan överförs från klor till kväve. Väteelektronen lämnas kvar på klor för att bilda en negativ kloridjon (Cl–).
Ammoniakbortrifluorid (NH3.BF3)
Bortrifluorid (BF3) är en förening som inte har en ädelgasstruktur runt boratomen (B). Boret har bara tre par elektroner i sitt valansskal och kräver ett par för att slutföra orbitalen. Därför är BF3 elektronbrist. Det ensamma paret på kväve (N) i ammoniakmolekylen (NH3) används för att övervinna den bristen och en komplex förening bildas genom en koordinatkovalent bindning.
Hydroniumjon (H3O+)
När väteklorid (HCl) Gas upplöses i vatten för att göra saltsyra (HCl aq.) bildas en koordinatkovalent bindning i hydroniumjonen. Väte (H) – kärnan överförs till vattenmolekylen (H2O), som har ett ensamt par elektroner för att bilda hydronium. Så, H bidrar inte med några elektroner till bindningen.
Aluminiumklorid (Al2Cl6)
bindningen i aluminiumklorid (AlCl3) är väsentligen kovalent. Varje aluminiumatom (Al) har ett underskott på två elektroner i sitt valansskal, och klor (Cl) har ett ensamt par. Al bildar en koordinatkovalent bindning med Cl-atomen på en intilliggande AlCl3-grupp. Eftersom var och en av två Al-atomer gör detta, är aluminiumklorid en kovalent dimermolekyl med formeln Al2Cl6.
kolmonoxid (CO)
kol (C) har fyra elektroner i sitt valensskal och syre (O) har sex. Både kol och syre delar sina två elektroner. Medan oktettregeln är nöjd med syre finns det fortfarande ett underskott på två elektroner på kolet. Så syre delar sina två elektroner med kol för att bilda en koordinatkovalent bindning, förutom de två vanliga (dubbla) kovalenta bindningarna.