basicitet av aminer och pKaH
kvantifiera Aminernas basicitet, med användning av ”PKA av Konjugatsyran”, aka ”pKaH”
hur mäter du basiciteten hos en amin? Typexempel: vad är en starkare bas: pyridin eller piperidin?
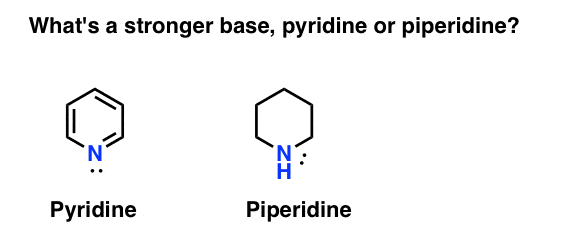
Om du sa piperidin, Grattis – det är verkligen en starkare bas.
men varför? Och hur mycket starkare? Hur går det att försöka svara på dessa frågor? När allt kommer omkring kan vi enkelt jämföra styrkan hos syror genom att undersöka deras pKa. borde vi inte kunna göra detsamma med baser?
ja, på ett sätt. Här är två viktiga punkter för idag:
- det bästa sättet att kvantifiera basiciteten hos en Amin är att undersöka pKa av dess konjugatsyra.
- ju högre PKA av konjugatsyran desto starkare är basen.
i det här inlägget visar vi några specifika exempel på hur man använder pKa-värden för att jämföra aminernas basicitet.
i ett efterföljande inlägg kommer vi sedan att utforska några viktiga trender som ligger till grund för aminernas basicitet.
Innehållsförteckning
- snabb granskning: syror, baser, Konjugatsyror och konjugatbaser
- använda pKa för att mäta surhet
- använda pKa för att kvantifiera Aminernas basicitet
- ”PKA för Konjugatsyran” kan förkortas som ”pKaH”
- använda pKaH för att bestämma de relativa Basiciteterna för aminer
- vissa ord var försiktig med PKA-värden för aminer
- vilka nyckelfaktorer styr Aminernas basicitet?
- anteckningar
1. Snabb Granskning: Syror, baser, Konjugatsyror och konjugatbaser
först, låt oss snabbt granska några basicitetsgrunder.
det finns fyra aktörer i varje syrabasreaktion.
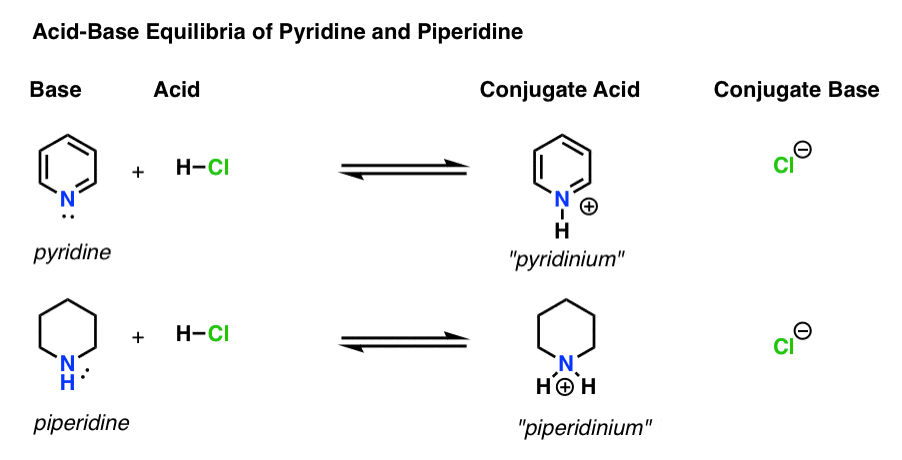
- basen är den art som donerar ett ensamt par till H+ (även känd som en ”proton” eller ”vätekärna”). Det är där den nya bindningen till H bildas (t .ex. pyridin, nedan)
- konjugatsyran är den art som resulterar efter att basen bildar en bindning till H (t. ex. ”pyridinium” , som har en ny N–h-Bindning)
- syran är den art som förlorar H+. Det är där bindningen till H bryts (t. ex. H-Cl)
- konjugatbasen är den art som återstår efter att syran donerar H+ till basen (t.ex. Cl -)
här är pyridin och piperidin i aktion. Genom att följa de band som bildar och bryter kan du identifiera varje skådespelare.
2. Använda pKa för att mäta surhet
varje syrabasreaktion kan skrivas som en jämvikt mellan en framåtriktad och omvänd reaktion. Vi har sett att surhetskonstanten, Ka, är ett mått på hur lätt en art dissocierar för att ge H+ och konjugatbasen.
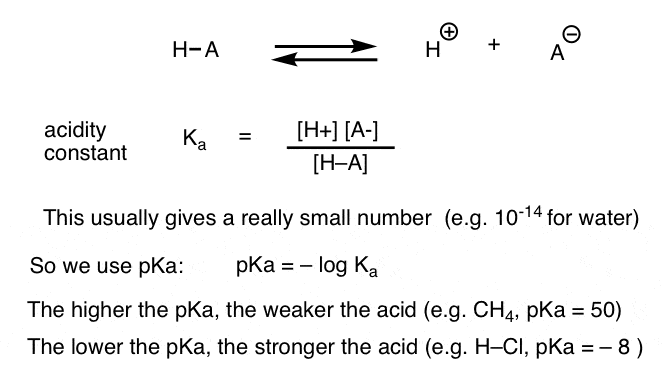
för bekvämlighet använder vi den negativa loggen av Ka, kallad pKa, som liknar den välbekanta pH-skalan men kan sträcka sig längre än 14 eftersom den inte är strikt begränsad till vattenhaltigt lösningsmedel. PKA-värdena sträcker sig från -10 eller så för mycket starka syror (t.ex. hydrojodsyra, H–I) till 50 och högre för vissa kolväten (t. ex. etan).
hur kan vi tillämpa dessa begrepp för att mäta basicitet? Kunde vi inte byta saker och definiera en term, Kb , som är jämvikten för hur lätt en art kombinerar med H+, definiera pKb som dess negativa logg och jämföra baser genom att titta på deras pKb-värden?
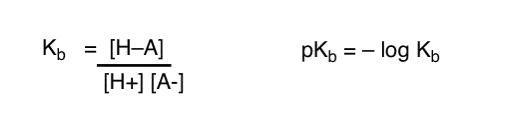
Ja…. det kan vi. Jag antar det. Om vi var tvungna att. Men i allmänhet är organiska kemisters åsikt om detta ämne ”skruv pKb”.
När allt kommer omkring har pKa-värden uppmätts för tusentals organiska molekyler. Vill någon verkligen behöva komma ihåg en enorm uppsättning pKb-värden också? Fan heller!
istället kan vi enkelt använda pKa-värden som en indirekt mätning av basicitet. Så här gör du.
3. Använda PKA-värden för att kvantifiera Aminernas basicitet
minns dessa två odödliga prosalinjer, värda att recitera för dig själv varje natt:
- ju starkare syran desto svagare är konjugatbasen.
- ju svagare syran desto starkare är konjugatbasen.
pKa för konjugatsyran av pyridin (”pyridinium”) har uppmätts. Det handlar om 5.2 .
Vi har också ett värde för pKa för konjugatsyran av piperidin. Det handlar om 11 .
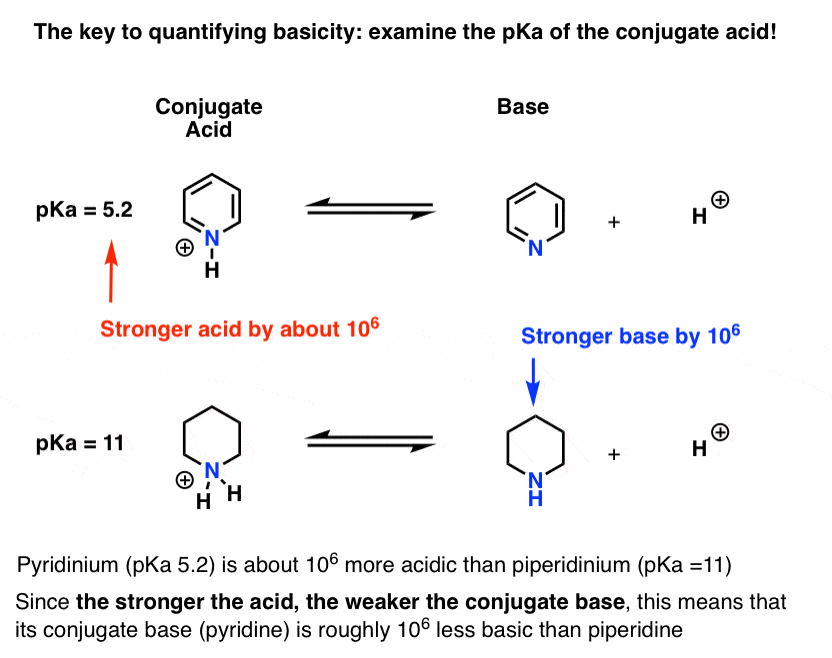
från dessa PKA-värden kan vi säga att konjugatsyran av pyridin är starkare än konjugatsyran av piperidin med cirka 6 pKa-enheter. Eftersom varje pKa-enhet representerar en faktor på 10 är det en faktor på cirka 1 miljon.
eftersom” ju starkare syran är, desto svagare är konjugatbasen”, är pyridin därför en svagare bas än piperidin med en faktor på 1 miljon.
4. ”PKA av Konjugatsyran ”kan förkortas som”pKaH ”
termen,” PKA av konjugatsyran ” är lite av en munfull att använda regelbundet. Att vara naturligt Lat, vi skulle vilja kondensera detta lite för vanligt bruk.
eftersom konjugatsyran i en bas (”B”) är” BH”, kan vi förkorta” PKA för konjugatsyran i en bas ” som dess pKaH.
detta låter oss säga att pkah av pyridin är 5,2 och pkah av piperidin är 11.
vi kan sedan gräva i litteraturen för att hitta andra baser att jämföra med.
till exempel, exakt hur grundläggande är ammoniak (NH3) ? Konjugatsyran av ammoniak, NH4 (+), är 9,2 . Likvärdigt kan vi säga att ammoniakens pkah är 9,2. Detta sätter det mellan pyridin och piperidin på basicitetsskalan.
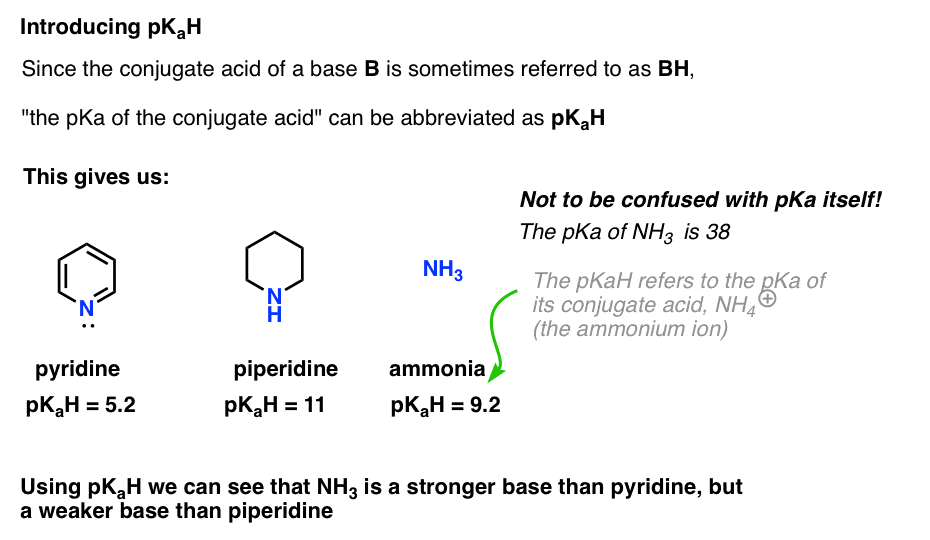
Observera att det är väldigt viktigt att inte förväxla pKaH med pKa. Ammoniakens pkah är 9,2, som mäter surheten hos dess konjugatsyra, NH4(+).
PKA av ammoniak i sig är 38, som mäter jämviktskonstanten för dissociation av NH3 för att ge sin konjugatbas, NH2(-) och H+.
det betyder att 38 är pkah för amidjonen NH2 ( – ), som du kanske har stött på tidigare som den starka basen (NaNH2) som används för att deprotonera terminala alkyner (pKa =25). Med hjälp av pKaH kan vi bestämma att NH2 ( – ) handlar om (38-9) = 29 storleksordningar mer grundläggande än NH3 !
5. Att använda pKaH för att bestämma de relativa Basiciteterna hos aminer
att använda pKaH för att bestämma basernas relativa styrkor är ett ganska användbart trick.
Här är några representativa exempel på kväveinnehållande molekyler. Nedan är pKa av deras konjugatsyror.
vad är den starkaste basen här? Vad är det svagaste?
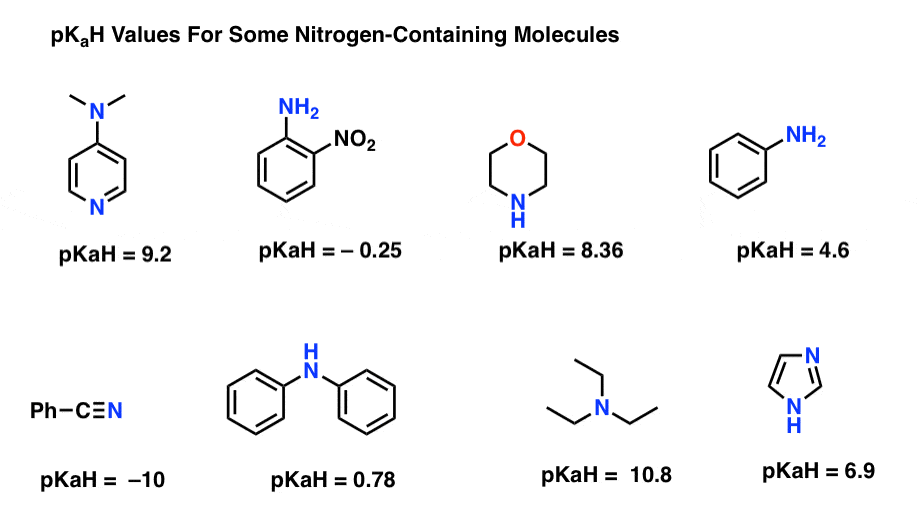
det lägsta pkah-värdet här är -10 för nitrilen (längst ner till vänster). Detta innebär att nitrilen är den minst grundläggande av alla dessa molekyler.
det högsta pkah-värdet här är 10,8 för trietylamin. Det gör trietylamin till den starkaste basen av alla listade.
några försiktighetsord på pKa-värden för aminer
två saker att se upp för, särskilt när man läser andra onlinekällor om detta ämne.
först rapporteras ibland pkah-värdena för aminer som pKa-värden , utan förklaring. De bästa PKA-borden gör inte detta, men det är svårt att sortera vete från agnarna när du precis börjar.
Om du ser ett onormalt lågt pKa-värde för en amin, hänvisar det sannolikt till pkah av konjugatsyran.
till exempel, här är en PKA-tabell där PKA av metylamin (CH3NH2) är listad som 10.63.
det är lågt. Förhoppningsvis vid denna tidpunkt bör ett sådant värde på 10 för en PKA av en amin slå dig så konstigt, särskilt eftersom pKa för den närbesläktade NH3 är 38.
värdet på 10,63 hänvisar faktiskt till pKa för konjugatsyran av metylaminer, inte metylamin i sig. Det är ett pKaH-värde.
På samma sätt listar samma tabell trimetylamin som att ha en pKa på 9,8 . Återigen är detta faktiskt dess pKaH. Jag kan inte hitta ett faktiskt pKa-värde för trimetylamin, men jag skulle gissa att det är >40, eftersom den konjugerade basen av trimetylamin är karbanionen (CH3)2n–CH2(–) ).
en sekund, mindre vanlig källa till förvirring är att ibland rapporteras pkah för en Amin som dess pKb, såsom i denna tabell som rapporterar pKb för NH3 som 9,2 . Detta är felaktigt.
återigen kommer pKb-värden inte riktigt upp mycket i grundorganisk kemi, även om jag får veta att de ibland gör ett utseende på DAT / MCAT.
7. Vilka Nyckelfaktorer Styr Aminernas Basicitet?
Nu när vi har lärt oss åtminstone hur man kvantifierar och tolkar pKa-värdena för aminer och deras konjugatsyror, kan vi börja ställa nyckelfrågan: varför? Vilka nyckelfaktorer styr aminernas basicitet? Vilka är de viktiga trenderna?
varför är pyridin till exempel en svagare bas än piperidin? Varför är nitriler ännu svagare baser? Varför tenderar elektronavdragande grupper att göra aminer svagare baser?
den goda nyheten är att om du redan förstår de faktorer som styr surheten, måste du helt enkelt tillämpa exakt samma principer – men i omvänd ordning!
Vi kommer att täcka det i nästa inlägg. Fem faktorer som påverkar Aminernas basicitet
anteckningar
fotnot 1. Det finns många syror som är icke-baser (såsom NH4 som saknar ett ensamt Par) och många baser som är icke-syror, såsom Cl (–), som inte kan acceptera ett ensamt par. Därför säger ”ju starkare syran, desto svagare är basen” fel.
fotnot 2. Det är mätningen som erhålls med vatten som lösningsmedel. Du kan se ett annat värde, 3.4, som erhålls när dimetylsulfoxid (DMSO) används som lösningsmedel. Se Bordwell PKA-tabeller (DMSO)