kemian oppija
mikä on koordinaatisto kovalenttinen sidos?
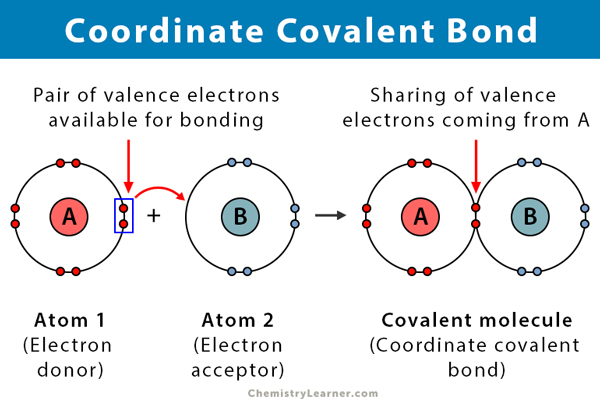
kovalenttinen sidos muodostuu kahden atomin jakaessa elektroneja. Koordinaattinen kovalenttinen sidos, joka tunnetaan myös datiivisena kovalenttisena sidoksena, on kovalenttisen sidoksen tyyppi, jossa jaettu elektronipari tulee yhdestä atomista. Atomit pysyvät koossa, koska molemmat ytimet vetävät puoleensa elektroniparia. Kun kovalenttinen sidos on muodostettu, on mahdotonta erottaa elektronien alkuperää. Tällainen sidos havaitaan tyypillisesti metalli-ionien sitoutuessa ligandeihin. Kuitenkin myös epämetallit voivat osallistua tähän sidokseen. Lewis-hapon ja emäksen välinen reaktio on koordinaatiston kovalenttinen sidos .
kompleksi-ioni muodostuu kahdesta asiasta, metalli-ionista ja yhdisteistä, joita kutsutaan ligandeiksi. Ligandit ovat neutraaleja molekyylejä tai ioneja, jotka sisältävät yksinäisiä elektronipareja, jotka voivat sitoutua metalli-ioniin. Yleisiä ligandeja ovat ammoniakki (NH3), vesi (H2O) ja halidi– ionit (Cl–, Br -). Ligandeja pidetään Lewis-emäksinä, koska ne jakavat elektroniparinsa metalli-ionin kanssa. Metalli-ionit ovat aina positiivisia, joten ne ovat melko houkuttelevia yksinäisille elektronipareille.
koordinaatin kovalenttisen sidoksen Faktat ja ominaisuudet
koordinaatin kovalenttisella sidoksella on monia yhtäläisyyksiä kovalenttisen sidoksen kanssa. Tässä muutamia sen ominaisuuksia:
- tapahtuu elektronin luovuttajan ja elektronin vastaanottajan välillä, tyypillisesti metallin ja ligandin välillä
- tapahtuu erilaisten atomien välillä
- muodostuu jonkin atomeista luovuttamien elektronien jakamisesta
- jäykkä ja suuntaava
- atomit noudattavat oktettisääntöä
- elektronit luovuttavaa atomia kutsutaan luovuttajaksi, ja ne vastaanottavaa atomia kutsutaan vastaanottajaksi.
- yhdisteet liukenevat niukasti veteen
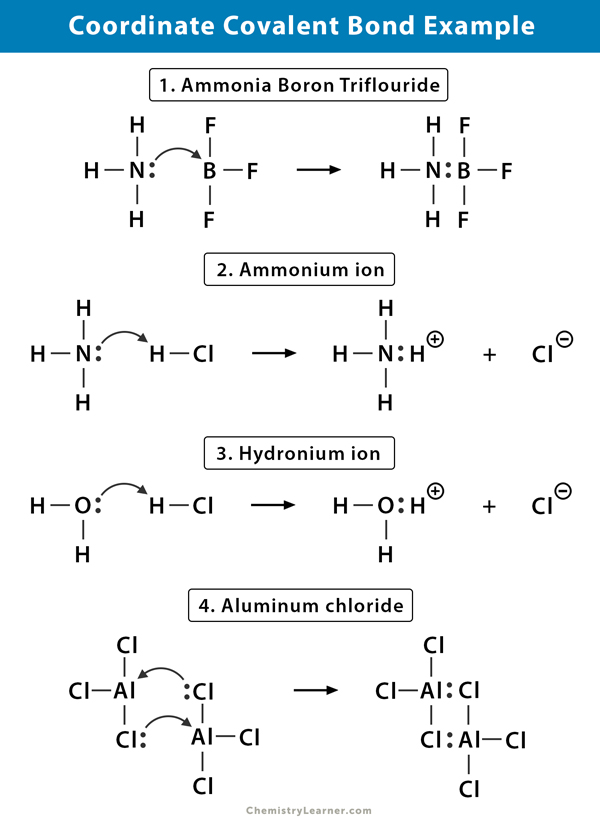
esimerkkejä koordinaatiston kovalenttisesta sidoksesta
Tässä muutamia esimerkkejä molekyyleistä, joissa koordinaatiston kovalenttinen sidos on olemassa .
Ammonium (NH4+) ioni
ammoniumioni muodostuu ammoniakin (NH3) kaasun reaktiosta vetykloridi (HCl) kaasun kanssa. NH4+: ssa neljäs vety on kiinni koordinaatistossa kovalenttisella sidoksella, koska vain vedyn ydin siirtyy kloorista typpeen. Vedyn elektroni jää klooriin muodostaen negatiivisen kloridi-ionin (cl -).
Ammoniakkibooritrifluoridi (NH3.BF3)
Booritrifluoridi (BF3) on yhdiste, jolla ei ole jalokaasurakennetta boori (B) – atomin ympärillä. Boorilla on valanssikuoressaan vain kolme elektroniparia ja orbitaalin läpiviemiseen tarvitaan pari. Näin ollen BF3 on elektronipuutos. Ammoniakkimolekyylin (NH3) typen (N) yksinäistä paria käytetään tämän puutteen voittamiseen, ja kompleksiyhdiste muodostuu koordinaatiston kovalenttisen sidoksen kautta.
Hydroniumioni (H3O+)
kun vetykloridikaasu (HCl) liukenee veteen muodostaen suolahappoa (HCl aq.), hydroniumionissa muodostuu koordinaatistolainen kovalenttinen sidos. Vedyn (H) ydin siirtyy veden (H2O) molekyyliin, jolla on yksinäinen elektronipari muodostaen hydroniumia. H ei siis osallistu lainkaan elektroneja sidokseen.
alumiinikloridi (Al2Cl6)
liimaus alumiinikloridissa (AlCl3) on pääosin kovalenttista. Jokaisella alumiini (Al) – atomilla on valanssikuoressaan kahden elektronin vajaus, ja kloorilla (Cl) on yksinäinen pari. Al muodostaa cl-atomin kanssa koordinaatiston kovalenttisen sidoksen viereisessä AlCl3-ryhmässä. Koska kumpikin kahdesta Al-atomista tekee tämän, niin alumiinikloridi on kovalentti dimeerimolekyyli, jonka kaava on Al2Cl6.
hiilimonoksidilla (CO)
hiilellä (C) on valenssikuoressaan neljä elektronia ja hapella (O) kuusi. Sekä hiili että happi jakavat kaksi elektroniaan. Vaikka oktettisääntö tyydyttyy Happeen, hiilessä on silti kahden elektronin vaje. Happi jakaa siis kaksi elektroniaan hiilen kanssa muodostaen koordinaatiston kovalenttisen sidoksen kahden säännöllisen (kahden) kovalenttisen sidoksen lisäksi.