inlägg taggade ”MO teori; cykloaddition; organisk kemi; HOMO; LUMO; konjugerat system”
ett av de mest utmanande begreppen i konjugerade systemreaktioner är molekylära orbitala interaktioner, eller MO teori. Grunderna för denna princip kan vara svåra att förstå, men kommer att vara mycket informativa för att förutsäga de korrekta reaktionsförhållandena och resultatet av reaktionen om du förstår dem, vilket ger dig en stor fördel i framtida frågesporter och tentor. Vi på StudyOrgo har tagit fram en enkel förklaring av grunderna till MO-teorin för att hjälpa dig med dina studieförberedelser.
principer för MO teori
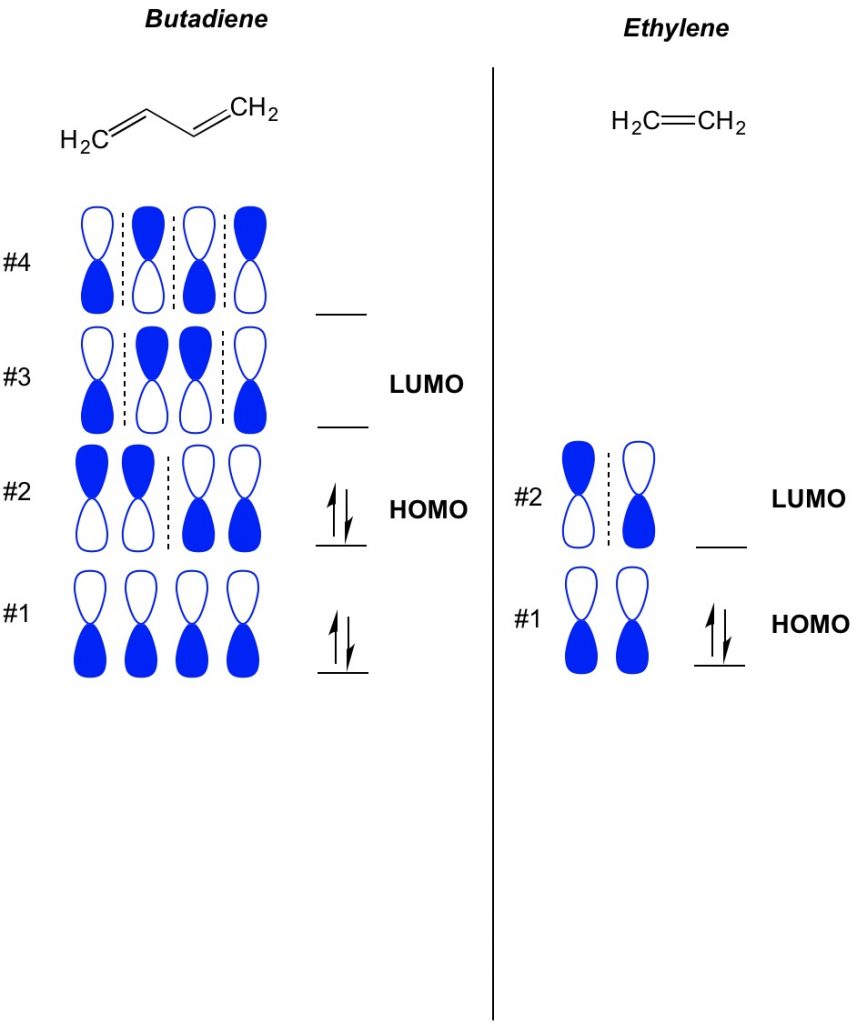
det grundläggande begreppet MO teori är att beskriva de alternerande mönster av orbitaler som finns i pi bond-System. Vi beskriver orienteringen av varje hälft av hantelbanan centrerad kring en atom som djärv eller öppen. Kom ihåg att det finns bindning och antibonding orbitaler. I huvudsak uppträder orbitaler med lägre antal noder (växlar i orienteringen av hantelbanan som vi visar med den streckade linjen) mer som bindningsorbitaler medan orbitaler med högre antal noder beter sig som antibindningsorbitaler. För att bestämma vilka orbitaler som är upptagna på din molekyl, räkna helt enkelt hur många pi-bindningar du har i ditt konjugerade system. Nedan är ett exempel på butadien. Den har 4 pi-elektroner, så vi fyller de lägsta molekylära orbitalerna först, två i varje orbital. Därför är den högsta ockuperade molekylära orbitalen, eller HOMO, i butadien #2. Som ett resultat är den lägsta oupptagna molekylära obitalen, eller LUMO, i butadien #3. Vi kan utvidga detta till eten och se att med 2 pi-elektroner är molekylär orbital #1 HOMO och molekylär orbital #2 är LUMO.
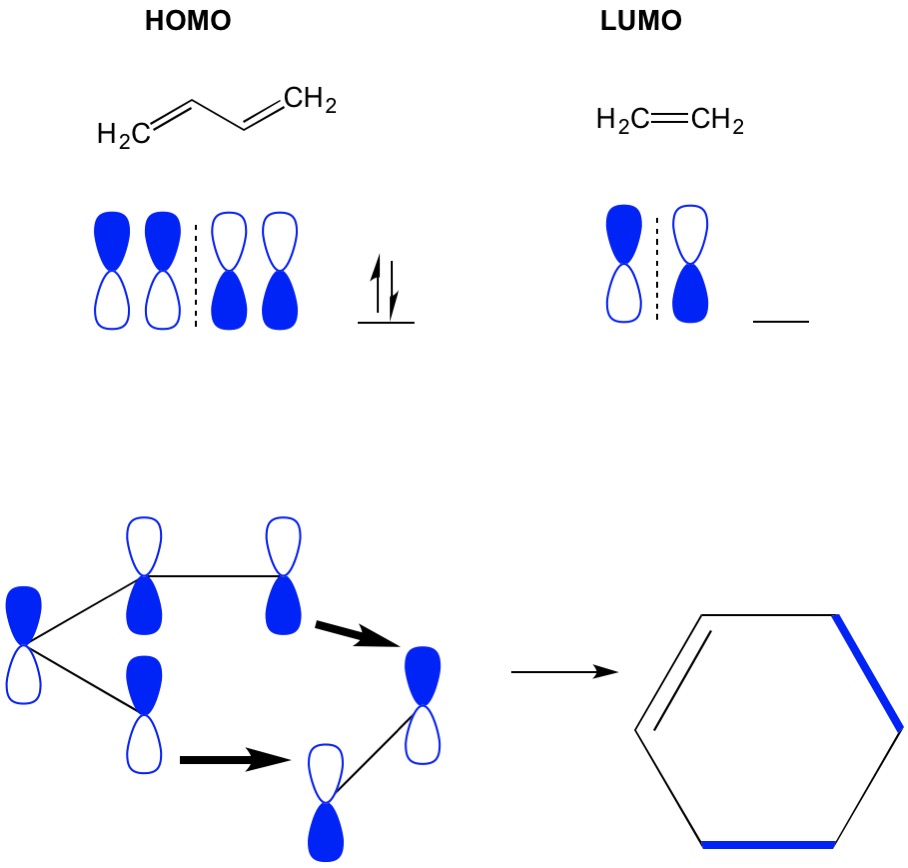
Cykloadditions Mo teori
Kom ihåg att cykloadditionsreaktioner beskriver bildandet av nya C-C sigma-bindningar genom omläggning av pi-elektronerna i ett konjugerat system. Därför måste vi använda pi-elektronernas molekylära orbitaler för att driva reaktionen. Låt oss ta reaktionen av butadien med eten, den mest förenklade Diels alderreaktionen (4+2 cykloaddition). Vi börjar med den mest konjugerade molekylen, butadien och undersöker dess HOMO. Sedan tittar vi på den minst konjugerade molekylen, eten och undersöker dess LUMO. Varför? Vi behöver elektronerna från en HOMO att strömma från en molekyl till en annan, så vi måste använda LUMO-orbitalen som inte är upptagen för denna process. Vi ser att noderna i HOMO och LUMO anpassar sig; det är de öppna och stängda halvorna av hantlarna. Detta leder till en framåtriktad reaktion och bildning av produkten, Cyklohexen.
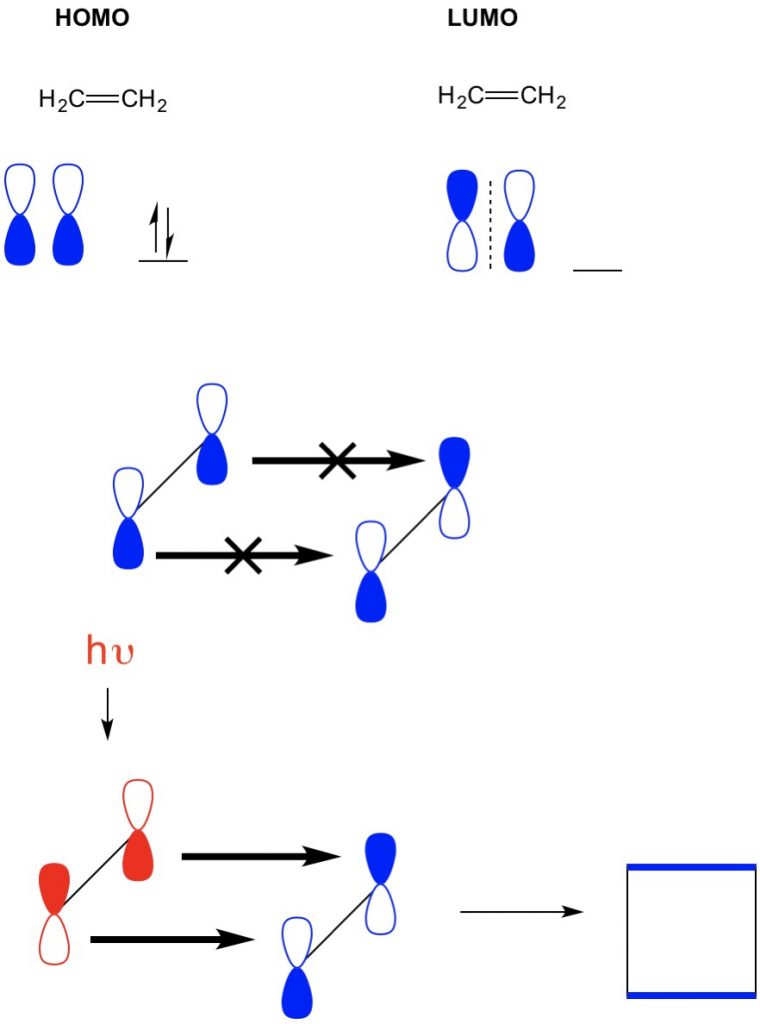
men i ett annat exempel där vi har en (2+2 cykloaddition) ser vi att HOMO och LUMO av eten inte anpassar sig så förbjuder reaktionen. Vi har emellertid förmågan att excitera elektroner från HOMO till en högre orbital med hjälp av ljus (hv) eller värme, vilket förändrar HOMO. Vi granskar detta koncept i detalj i en tidigare artikel. När vi gör detta, homo av upphetsad eten och LUMO av mark-state etylen justera och reaktionen producerar cyklobutan.
Vi hoppas att denna beskrivning har hjälpt till att klargöra dessa begrepp i MO-teorin. Detta är ett exempel på de tydliga och enkla expatiationerna vi har förberett för över 175 reaktioner som vanligtvis ses i Orgo1-och Orgo2-kurser. Anmäl dig idag för dina studieförberedelsebehov!