gemensam Joneffekt
vetenskap > Kemi > fysikalisk kemi > jonisk jämvikt > gemensam Joneffekt
i den här artikeln ska vi studera den gemensamma Joneffekten och dess tillämpningar.
fenomenet där graden av dissociation av någon svag elektrolyt undertrycks genom tillsats av en liten mängd stark elektrolyt innehållande en gemensam Jon kallas en gemensam joneffekt.
exempel – 1: (Dissociation av en Svagsyra)
jonisering av svag elektrolytättiksyra (CH3COOH)undertrycks genom tillsats av starkt elektrolytnatriumacetat (CH3COONa)innehållande vanlig acetatjon (CH3COO–)
förklaring:
Antag att en elektrolytättiksyra (CH3COOH) ärbehandlad med vatten. Det dissocierar och en jämvikt existerarenligt följande,
CH3COOH(aq) ch3coo–(aq) + H+(aq)
genom att tillämpa lagen om massåtgärd,
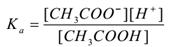
där ” Ka ” är dissociationskonstanten för syra.
om en liten mängd av en stark elektrolyt som natriumacetat (CH3COONa) sättes till den vattenhaltiga lösningen av CH3COOH, blir den dissocierad och jämvikt existerar, eftersom
CH3COONa(aq) ch3coo–(aq) + Na+(aq)
här är CH3COO– joner vanliga, varför deras koncentration ökar. Enligt Le-Chateliers princip skiftar jämvikten mot vänster. För att hålla värdet av Ka konstant ökar koncentrationen av CH3COOH-molekyler. På detta sätt undertrycks jonisering av CH3COOH genom tillsats av CH3COONa. Således ökar lösningens pH.
exempel – 2: (dissociation av en Svagbas):
jonisering av svag elektrolytammoniumhydroxid (NH4OH)undertrycks genom tillsats av stark elektrolytammoniumklorid (NH4Cl) innehållandevanlig ammoniumjon (NH4+)
förklaring:
Antag att en elektrolytammoniumhydroxid (NH4OH)behandlas med vatten. Det dissocierar och en jämvikt existerarenligt följande,
NH4OH(aq) Aci NH4+(aq) + OH–(aq)
genom att tillämpa lagen om massåtgärd,
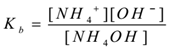
där ’KB’ är dissociationskonstant för basen.
om en liten mängd av en stark elektrolyt som ammoniumklorid (NH4Cl) sättes till den vattenhaltiga lösningen av NH4OH, blir det dissocierad och jämvikt existerar, som
NH4Cl(aq) ASIC NH4+(aq) + Cl–(aq)
Här NH4+ joner är vanliga därmed deras koncentration ökar. Enligt Le-Chateliers princip skiftar jämvikten mot vänster. För att hålla värdet på Kb konstant ökar koncentrationen av NH4OH-molekyler. På detta sätt undertrycks jonisering av NH4OH genom tillsats av NH4Cl. Således minskar lösningens pH.
tillämpningar av gemensam Joneffekt:
rening av vanligt Salt:
princip:
tillsatsen av vanlig Jon till en mättad lösning av salt orsakar utfällning av salt. När den joniska produkten överstiger löslighetsprodukten sker nederbörd.
processoch förklaring:
en mättad lösning av vanligt salt, fri frånsuspenderade föroreningar tas och HCl-gas passeras genom den. I en mättadlösning av Oren NaCI, jämvikt existerar enligt följande,
NaCl(aq) Cl Na+(aq) + Cl–(aq)
om ren HCI–gas passerar genom denna lösning, varstark elektrolyt, det dissocierar nästan fullständigt och jämvikt existerar,
HCl(aq) cl h+(aq) + Cl– (aq)
Nu Cl-är en vanlig Jon. Koncentrationenav CI-joner (vanliga joner) ökar. Enligt toLe-Chateliers princip skiftar jämvikten mot vänster. Dissociation av NaCI undertrycks och ren NaCI fälls ut som fastsalt. Således kan ren NaCI fällas ut genom att passera HCI-gas imättad lösning av Oren NaCI.
saltning av tvål:
princip:
tillsatsen av vanlig Jon till en mättad lösning av salt orsakar utfällning av salt. När den joniska produkten överstiger löslighetsprodukten sker nederbörd.
processoch förklaring:
tvål är natriumsalt av högre fettsyror(RCOONa). Den framställs genom hydrolys av oljor med NaOH. I den mättade tvållösningen finns det en jämvikt,
ROONa(aq) rcoo–(aq) + Na+(aq)
om en liten mängd NaCl tillsätts till den mättade tvållösningen, dissocieras den som
NaCl(aq) cl+(aq) + Cl–(aq)
koncentration av Na+ joner (vanlig Jon) ökar. På grund av den gemensamma joneffekten minskar dissociationen av tvål och tvål fälls ut och kan sedan lätt avlägsnas från tvållösningen. Denna process för att få fast tvål från tvållösning, genom att tillsätta salt som NaCI kallas saltning av tvål.