efectul ionic comun
știință > Chimie > Chimie Fizică > echilibrele Ionice > div> efect Ionic comun
în acest articol, vom studia efectul ionic comun și aplicațiile sale.
fenomenul în care gradul de disociere a oricărui electrolit slab este suprimat prin adăugarea unei cantități mici de electrolit puternic care conține un ion comun se numește efect ionic comun.
exemplu – 1: (disocierea unui acid slab)
ionizarea acidului acetic slab electrolitic (CH3COOH)este suprimată prin adăugarea de acetat de sodiu puternic electrolit (CH3COONa)care conține Ion acetat comun (CH3COO–)
explicație:
Să presupunem că un acid acetic electrolit (CH3COOH) este tratat cu apă. Se disociază și există un echilibrudupă cum urmează,
CH3COOH(aq) ch3coo–(aq) + H+(aq)
prin aplicarea legii acțiunii în masă,
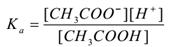
unde ” ka ” este constanta de disociere a acidului.
dacă o cantitate mică de electrolit puternic ca acetat de sodiu (CH3COONa) se adaugă la soluția apoasă de CH3COOH, se disociază și există echilibru, deoarece
CH3COONa(aq) ch3coo–(AQ) + Na+(AQ)
aici CH3COO– ionii sunt comuni, prin urmare, concentrația lor crește. Conform principiului lui Le-Chatelier, echilibrul se deplasează spre stânga. Pentru a menține valoarea ka constantă, concentrația moleculelor CH3COOH este crescută. În acest fel, ionizarea CH3COOH este suprimată prin adăugarea CH3COONa. Astfel, pH-ul soluției crește.
Exemplul – 2: (disocierea unei baze slabe):
ionizarea hidroxidului de amoniu electrolit slab (NH4OH)este suprimată prin adăugarea de clorură de amoniu electrolit puternic (NH4Cl) care conține ionul de amoniu comun (NH4+)
explicație:
Să presupunem că un hidroxid de amoniu electrolit (NH4OH)este tratat cu apă. Se disociază și există un echilibrudupă cum urmează,
NH4OH(aq) NH4+(aq) + OH–(aq)
prin aplicarea legii acțiunii în masă,
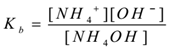
unde ‘Kb’ este constanta de disociere a bazei.
dacă o cantitate mică de electrolit puternic, cum ar fi clorura de amoniu (nh4cl), se adaugă la soluția apoasă de NH4OH, se disociază și există echilibru, deoarece
nh4cl(aq) NH4+(aq) + Cl–(aq)
aici ionii NH4+ sunt comuni, prin urmare, concentrația lor crește. Conform principiului lui Le-Chatelier, echilibrul se deplasează spre stânga. Pentru a menține valoarea Kb constantă, concentrația moleculelor de NH4OH este crescută. În acest fel, ionizarea NH4OH este suprimată prin adăugarea NH4Cl. Astfel, pH-ul soluției scade.
aplicații ale efectului Ionic comun:
purificarea sării comune:
principiu:
adăugarea ionului comun la o soluție saturată de sare determină precipitarea sării. Când produsul ionic depășește produsul de solubilitate, are loc precipitarea.
Procesși explicație:
se ia o soluție saturată de sare obișnuită, fără impurități suspendate și se trece prin ea gazul HCl. Într–o soluție saturată de NaCI impuri, echilibrul există după cum urmează,
NaCl(aq) na+(aq) + Cl–(aq)
dacă gazul HCI pur este trecut prin această soluție, fiind un electrolit puternic, se disociază aproape complet și există echilibru,
HCl(aq) h+(aq) + Cl– (aq)
acum Cl-este un ion comun. Concentrația ionilor CI (ioni comuni) este crescută. Conform principiului lui toLe-Chatelier echilibrul se deplasează spre stânga. Disocierea NaCI este suprimată și NaCI pur este precipitat ca solidsare. Astfel, NaCI pur poate fi precipitat prin trecerea gazului HCI în soluție saturată de NaCI impuri.
sărare din săpun:
principiu:
adăugarea ionului comun la o soluție saturată de sare determină precipitarea sării. Când produsul ionic depășește produsul de solubilitate, are loc precipitarea.
Processand explicație:
săpunul este sarea de sodiu a acizilor grași superiori(RCOONa). Se prepară prin hidroliza uleiurilor cu NaOH. În soluția saturată de săpun există un echilibru,
ROONa(aq) rcoo–(aq) + Na+(aq)
dacă se adaugă o cantitate mică de NaCl la soluția saturată de săpun, aceasta se disociază ca
NaCl(aq) na+(aq) + Cl–(aq)
concentrația ionilor de Na+ (Ion comun) crește. Datorită efectului ionic comun, disocierea săpunului este scăzută și săpunul se precipită și apoi poate fi îndepărtat cu ușurință din soluția de săpun. Acest proces de obținere a săpunului solid din soluția de săpun, prin adăugarea de sare ca NaCI se numește sărare din săpun.