cursant de Chimie
ce este o legătură covalentă coordonată?
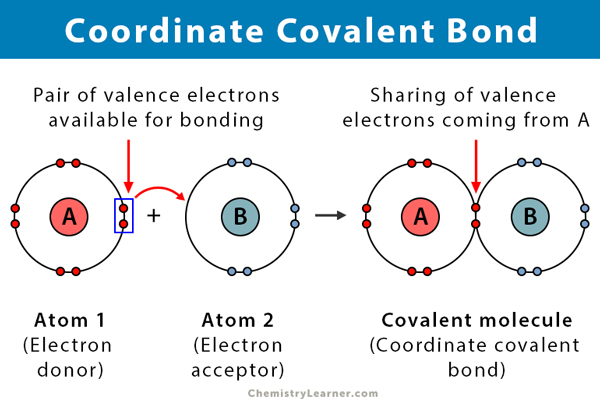
o legătură covalentă se formează atunci când doi atomi împărtășesc electroni. O legătură covalentă coordonată, cunoscută și sub numele de legătură covalentă dativă, este un tip de legătură covalentă în care perechea comună de electroni provine de la unul dintre atomi. Atomii sunt ținuți împreună, deoarece ambele nuclee atrag perechea de electroni. Odată ce se formează legătura covalentă, este imposibil să se distingă originea electronilor. Acest tip de legătură este de obicei observată în legarea ionilor metalici la liganzi. Cu toate acestea, nemetalele pot participa și la această legătură. Reacția dintre acidul Lewis și bază este o legătură covalentă coordonată .
un ion complex este format din două lucruri, un ion metalic și compuși numiți liganzi. Liganzii sunt molecule neutre sau ioni care conțin perechi de electroni singuri care se pot lega cu ionul metalic. Liganzii obișnuiți sunt amoniacul (NH3), apa (H2O) și ionii de halogenuri (Cl–, Br–). Liganzii sunt considerați baze Lewis deoarece își împart perechile de electroni cu ionul metalic. Ionii metalici sunt întotdeauna pozitivi, deci sunt destul de atrăgători pentru perechile singure de electroni.
fapte și proprietăți ale legăturii covalente de coordonate
legătura covalentă de coordonate are multe asemănări cu cea a legăturii covalente. Iată câteva dintre proprietățile sale:
- are loc între un donator de electroni și un acceptor de electroni, de obicei între un metal și un ligand
- are loc între atomi diferiți
- formați prin împărțirea electronilor donați de unul dintre atomii
- rigizi și direcționali
- Polar
- atomii urmează regula octetului
- compușii sunt puțin solubili în apă
i atomul care donează electronii se numește donator, iar atomul care îi acceptă se numește acceptor.
Exemple de legătură covalentă de coordonate
iată câteva exemple de molecule în care există legătură covalentă de coordonate .
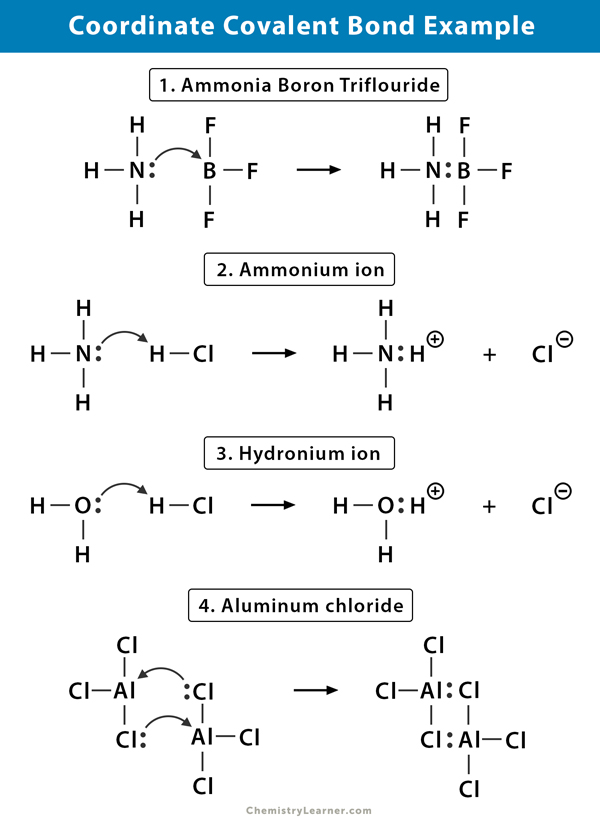
Ion de amoniu (NH4+)
ionul de amoniu este format din reacția gazului de amoniac (NH3) cu gaz de clorură de hidrogen (HCl). În NH4+, al patrulea hidrogen este atașat printr-o legătură covalentă coordonată, deoarece numai nucleul hidrogenului este transferat de la clor la azot. Electronul hidrogenului este lăsat în urmă pe clor pentru a forma un ion de clorură negativă (Cl–).
Trifluorura de bor amoniac (NH3.BF3)
trifluorura de bor (BF3) este un compus care nu are o structură de gaz nobil în jurul atomului de bor (B). Borul are doar trei perechi de electroni în învelișul său de valanță și necesită o pereche pentru a finaliza orbitalul. Prin urmare, BF3 este deficit de electroni. Perechea singuratică de azot (N) a moleculei de amoniac (NH3) este utilizată pentru a depăși această deficiență și se formează un compus complex printr-o legătură covalentă de coordonate.
Ion hidroniu (H3O+)
când gazul de clorură de hidrogen (HCl) se dizolvă în apă pentru a face acid clorhidric (HCl aq.), se formează o legătură covalentă coordonată în ionul hidroniu. Nucleul de hidrogen (H) este transferat în molecula de apă (H2O), care are o pereche singură de electroni pentru a forma hidroniu. Deci, H nu contribuie cu electroni la legătură.
clorură de aluminiu (Al2Cl6)
legarea în clorură de aluminiu (AlCl3) este în esență covalentă. Fiecare atom de aluminiu (Al) are un deficit de doi electroni în învelișul său de valanță, iar clorul (Cl) are o pereche singură. Al formează o legătură covalentă de coordonate cu atomul Cl pe un grup AlCl3 adiacent. Deoarece fiecare dintre cei doi atomi de Al face acest lucru, atunci clorura de aluminiu este o moleculă dimer covalentă cu formula Al2Cl6.
monoxid de Carbon (CO)
carbonul (C) are patru electroni în învelișul său de valență, iar oxigenul (O) are șase. Atât carbonul, cât și oxigenul își împart cei doi electroni. În timp ce regula octetului este satisfăcută de oxigen, există încă un deficit de doi electroni pe carbon. Deci, oxigenul împarte cei doi electroni cu carbonul pentru a forma o legătură covalentă coordonată, pe lângă cele două legături covalente regulate (duble).