bazicitatea aminelor și pKaH
cuantificând bazicitatea aminelor, folosind „pKa a acidului conjugat”, alias „pKaH”
cum măsurați bazicitatea unei amine? Cazul în cauză: ce este o bază mai puternică: piridină sau piperidină?
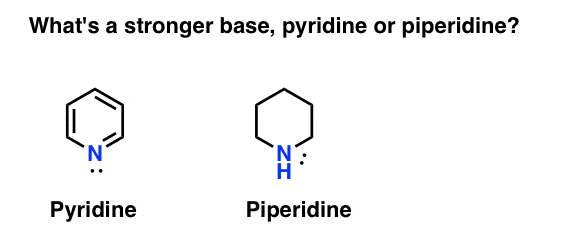
dacă ați spus piperidină, felicitări – este într-adevăr o bază mai puternică.
dar de ce? Și cât de mult mai puternic? Cum se merge despre încercarea de a răspunde la aceste întrebări? La urma urmei, putem compara cu ușurință puterea acizilor examinând pKa-urile lor. nu ar trebui să putem face același lucru cu bazele?
da, într-un fel. Iată două puncte cheie pentru astăzi:
- cel mai bun mod de a cuantifica bazicitatea unei amine este de a examina pKa a acidului său conjugat.
- cu cât este mai mare pKa a acidului conjugat, cu atât este mai puternică baza.
în această postare vă vom arăta câteva exemple specifice despre cum să utilizați valorile pKa pentru a compara bazicitatea aminelor.
într-o postare ulterioară, vom explora apoi câteva tendințe cheie care stau la baza bazicității aminelor.
cuprins
- recenzie rapidă: acizi, baze, acizi conjugați și baze Conjugate
- folosind pKa pentru a măsura aciditatea
- folosind pKa pentru a cuantifica bazicitatea aminelor
- „pKa acidului conjugat” poate fi prescurtat ca „pKaH”
- folosind pKaH pentru a determina Bazicitățile Relative ale aminelor
- câteva cuvinte de precauție privind valorile PKA pentru Amine
- ce factori cheie guvernează bazicitatea aminelor?
- Note
1. Recenzie Rapidă: Acizi, baze, acizi conjugați și baze Conjugate
În primul rând, să revizuim rapid câteva elemente de bază ale bazicității.
există patru actori în fiecare reacție acido-bazică.
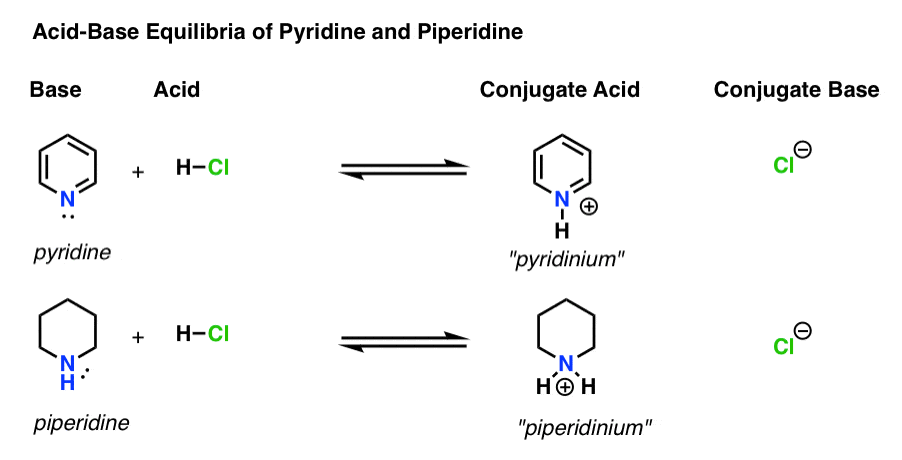
- baza este specia care donează o pereche singuratică lui H+ (cunoscută și sub numele de „proton” sau „nucleu de hidrogen”). Este locul în care noua legătură cu H formează (de exemplu, piridină , mai jos)
- acidul conjugat este specia care rezultă după ce baza formează o legătură cu H (de exemplu, „piridiniu”, care are o nouă legătură N–H)
- acidul este specia care pierde H+ . Este locul în care se rupe legătura cu H (de ex. H-Cl)
- baza conjugată este specia care rămâne după ce acidul donează H+ bazei (de exemplu, Cl -)
Iată piridina și piperidina în acțiune. Urmând legăturile care se formează și se rup, puteți identifica fiecare actor.
2. Folosind pKa pentru a măsura aciditatea
fiecare reacție acido-bazică poate fi scrisă ca un echilibru între o reacție înainte și inversă. Am văzut că constanta de aciditate, Ka, este o măsură a cât de ușor se disociază o specie pentru a da H+ și baza conjugată.
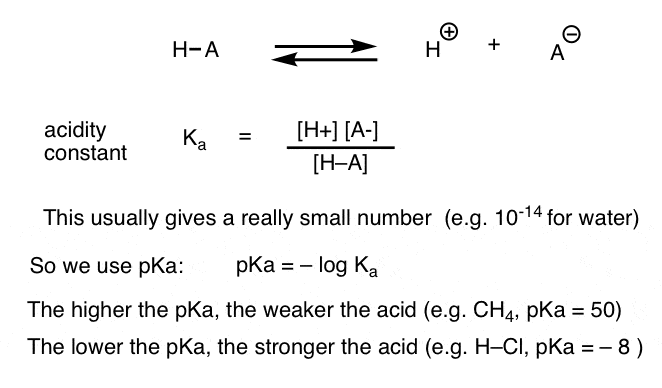
pentru comoditate, folosim Jurnalul negativ al Ka, numit pKa, care este similar cu scara pH familiară, dar se poate extinde dincolo de 14, deoarece nu este strict limitat la solventul apos. valorile pKa variază de la -10 sau cam asa ceva pentru acizi foarte puternici (de exemplu, acid hidroiodic, H–I) la 50 și mai mult pentru anumite hidrocarburi (de exemplu, etan).
cum putem aplica aceste concepte pentru a măsura bazicitatea? Nu am putea schimba lucrurile și să definim un termen, Kb , care este echilibrul pentru cât de ușor se combină o specie cu H+, să definim pKb ca jurnal negativ și să comparăm bazele uitându-ne la valorile lor pKb?
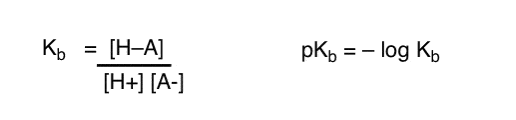
Da…. am putea. Cred. Dacă ar trebui. Dar, în general, opinia chimiștilor organici cu privire la acest subiect este „șurub pKb”.
la urma urmei, valorile pKa au fost măsurate pentru mii de molecule organice. Chiar vrea cineva să-și amintească și un set imens de valori pKb? La naiba, nu!
în schimb, putem folosi cu ușurință valorile pKa ca o măsurare indirectă a bazicității. Iată cum.
3. Folosind valorile pKa pentru a cuantifica bazicitatea aminelor
amintiți-vă aceste două linii nemuritoare de proză, care merită recitate în fiecare noapte:
- Cu cât acidul este mai puternic, cu atât baza conjugată este mai slabă.
- cu cât acidul este mai slab, cu atât baza conjugată este mai puternică.
pKa pentru acidul conjugat al piridinei („piridiniu”) a fost măsurată. Este vorba despre 5.2 .
avem, de asemenea, o valoare pentru pKa pentru acidul conjugat al piperidinei. Este vorba despre 11 .
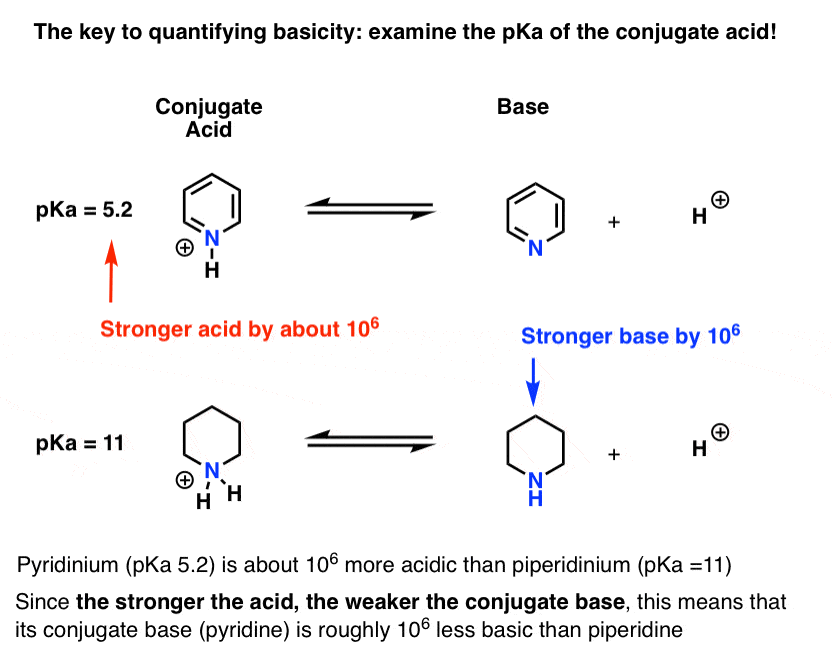
Din aceste valori pKa, putem spune că acidul conjugat al piridinei este mai puternic decât acidul conjugat al piperidinei cu aproximativ 6 unități pKa. Deoarece fiecare unitate pKa reprezintă un factor de 10, acesta este un factor de aproximativ 1 milion.
deoarece „cu cât acidul este mai puternic, cu atât baza conjugată este mai slabă”, piridina este, prin urmare, o bază mai slabă decât piperidina cu un factor de 1 milion.
4. „PKa acidului conjugat „poate fi abreviat ca”pKaH „
termenul,” pKa acidului conjugat ” este un pic de o îmbucătură pentru a utiliza în mod regulat. Fiind în mod natural leneș, am dori să condenseze acest lucru un pic pentru uz comun.
deoarece acidul conjugat al unei baze („B”) este „BH”, putem abrevia „pKa al acidului conjugat al unei baze” ca pKaH.
Acest lucru ne permite să spunem că pKaH-ul piridinei este 5,2, iar pKaH-ul piperidinei este 11.
putem săpa apoi în literatură pentru a găsi alte baze cu care să o comparăm.
de exemplu, cât de bazic este amoniacul (NH3) ? Acidul conjugat al amoniacului, NH4 (+), este 9.2 . Echivalent, putem spune că pKaH de amoniac este 9.2. Acest lucru îl plasează între piridină și piperidină pe scara de bazicitate.
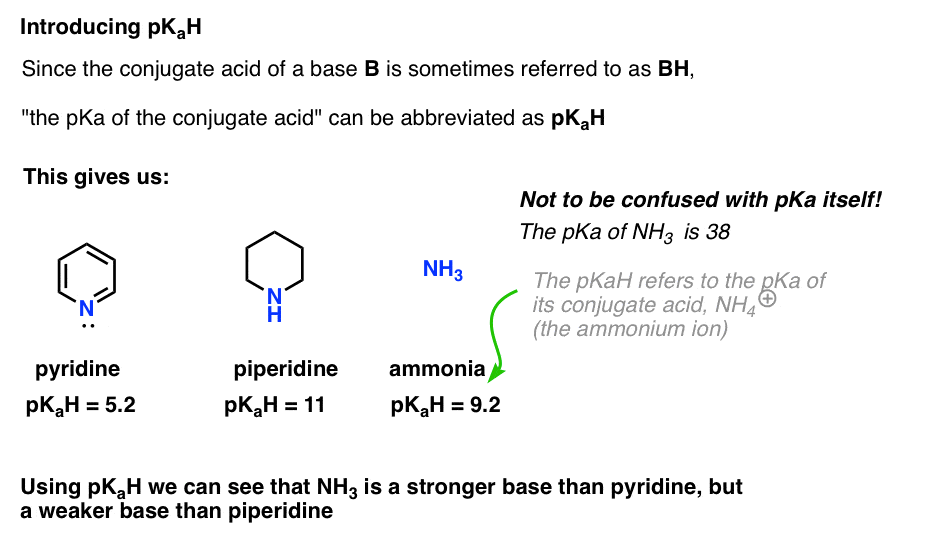
rețineți că este foarte important să nu confundați pKaH cu pKa. PKaH de amoniac este 9.2, care măsoară aciditatea acidului conjugat, NH4(+).
pKa amoniacului în sine este 38, care măsoară constanta de echilibru pentru disocierea NH3 pentru a da baza conjugată, NH2(-) și H+.
asta înseamnă că 38 este pKaH al ionului amidic NH2(–), pe care l-ați întâlnit înainte ca bază puternică (NaNH2) folosită pentru deprotonarea alchinelor terminale (pKa =25). Folosind pKaH, putem determina că NH2 (–) este de aproximativ (38 – 9) = 29 de ordine de mărime mai de bază decât NH3 !
5. Utilizarea pKaH pentru a determina elementele de bază Relative ale aminelor
utilizarea pKaH pentru a determina punctele forte relative ale bazelor este un truc destul de util.
iată câteva exemple reprezentative de molecule care conțin azot. Mai jos este pKa a acizilor lor conjugați.
care este cea mai puternică bază aici? Care este cel mai slab?
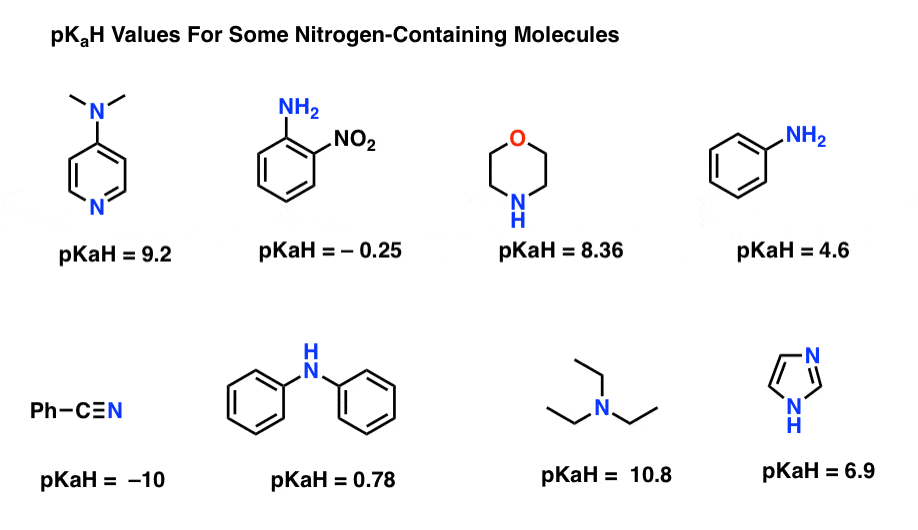
cea mai mică valoare pKaH aici este -10 pentru nitril (stânga jos). Aceasta înseamnă că nitrilul este cel mai puțin de bază dintre toate aceste molecule.
cea mai mare valoare pKaH aici este 10,8 pentru trietilamină. Asta face ca trietilamina să fie cea mai puternică bază dintre toate cele enumerate.
câteva cuvinte de precauție privind valorile pKa pentru Amine
două lucruri de care trebuie să aveți grijă, mai ales atunci când citiți alte surse online pe această temă.
În primul rând, uneori valorile pKaH pentru Amine sunt raportate ca valori pKa , fără explicații. Cele mai bune mese pKa nu vor face acest lucru, dar este greu să sortați grâul de pleavă atunci când abia începeți.
dacă vedeți o valoare anormal de scăzută pKa pentru o amină, este probabil referindu-se la pKaH a acidului conjugat.
de exemplu, iată un tabel pKa în care pKa de metilamină (CH3NH2) este listat ca 10.63.
care este scăzut. Sperăm că până în acest moment, o astfel de valoare de 10 pentru un pKa al unei amine ar trebui să vă pară ciudată, mai ales că pKa al NH3 strâns legat este 38.
valoarea de 10,63 se referă de fapt la pKa a acidului conjugat de metil amină, nu la metilamină în sine. Este o valoare pKaH.
în mod similar, același tabel listează trimetilamina ca având un pKa de 9,8 . Din nou, acesta este de fapt pKaH-ul său. Nu pot găsi o valoare reală pKa pentru trimetilamină, dar aș ghici că este >40, deoarece baza conjugată a trimetilaminei este carbanionul (CH3)2N–CH2(–) ).
o a doua sursă de confuzie mai puțin frecventă este că uneori pKaH-ul unei amine este raportat ca pKb-ul său, cum ar fi în acest tabel care raportează pKb-ul NH3 ca 9.2 . Acest lucru este inexact.
Din nou, valorile pKb nu prea apar în chimia organică de licență, deși mi se spune că uneori apar pe DAT / MCAT.
7. Ce Factori Cheie Guvernează Bazicitatea Aminelor?
acum că am învățat cel puțin cum să cuantificăm și să interpretăm valorile pKa ale aminelor și acizilor conjugați ai acestora, putem începe să punem întrebarea cheie: de ce? Ce factori cheie guvernează bazicitatea aminelor? Care sunt tendințele importante?
de exemplu, de ce piridina este o bază mai slabă decât piperidina? De ce sunt nitrilii baze chiar mai slabe? De ce grupurile de retragere a electronilor tind să facă aminele baze mai slabe?
vestea bună este că, dacă înțelegeți deja factorii care guvernează aciditatea, trebuie pur și simplu să aplicați exact aceleași principii – dar invers!
vom acoperi asta în următoarea postare. Cinci factori care afectează bazicitatea aminelor
Note
nota de subsol 1. Există mulți acizi care sunt non-baze (cum ar fi NH4 căruia îi lipsește o pereche singură) și multe baze care sunt non– acizi, cum ar fi Cl ( – ), care este incapabil să accepte o pereche singură. Prin urmare, a spune „cu cât acidul este mai puternic, cu atât baza este mai slabă” este greșită.
nota de subsol 2. Aceasta este măsurarea obținută folosind apa ca solvent. S-ar putea să vedeți o altă valoare, 3.4, care se obține atunci când dimetilsulfoxidul (DMSO) este utilizat ca solvent. Vezi tabelele Bordwell pKa (DMSO)