Basicidade de Aminas E pKaH
A Quantificação da Basicidade De Aminas, Usando “O pKa Do Ácido Conjugado”, um.k.a. “pKaH”
Como medir a basicidade de aminas? Caso em questão: o que é uma base mais forte: piridina ou piperidina?
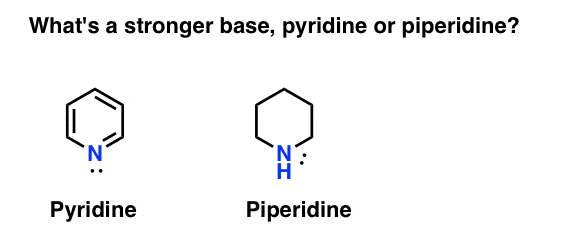
Se você disse piperidina, parabéns – é realmente uma base mais forte.mas porquê? E quanto mais forte? Como se tenta responder a estas perguntas? Afinal de contas, podemos facilmente comparar a força dos ácidos examinando seus pKa. não deveríamos ser capazes de fazer o mesmo com bases?sim, de certa forma. Aqui estão dois pontos chave para hoje:
- A melhor maneira de quantificar a basicidade de uma amina é examinar o pKa de seu ácido conjugado.quanto maior o pKa do ácido conjugado, mais forte a base.
neste post vamos mostrar alguns exemplos específicos de como usar os valores de pKa para comparar a basicidade das aminas.
em um post posterior, vamos então explorar algumas tendências fundamentais subjacentes à basicidade das aminas.
Índice
- Revisão Rápida: Ácidos, Bases, Conjugado Ácidos, e o Conjugado Bases
- Usando os valores de pKa Para Medir a Acidez
- Usando os valores de pKa Para Quantificar A Basicidade De Aminas
- O “pKa Do Ácido Conjugado” Pode Ser Abreviado Como “pKaH”
- Usando pKaH Para Determinar A Relativa Basicities De Aminas
- Algumas Palavras De Cautela Em Valores de pKa Para Aminas
- o Que Factores-Chave que Regem A Basicidade De Aminas?Notas 1. Revisão Rápida: Ácidos, Bases, ácidos conjugados e Bases conjugadas
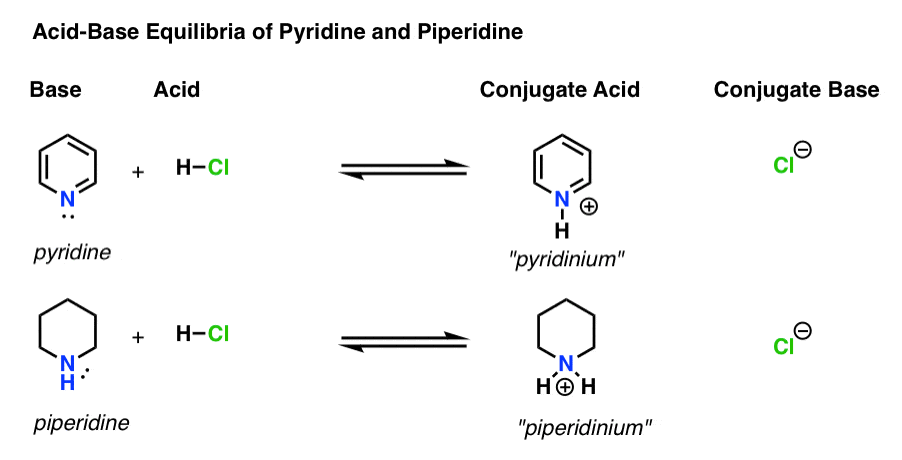
primeiro, vamos rever rapidamente algumas noções básicas de basicidade.há quatro actores em cada reacção ácido-base.
- a base é a espécie que doa um par solitário A H+ (também conhecido como “próton” ou “núcleo de hidrogênio”). É onde a nova ligação a H se forma (por exemplo, piridina, abaixo)
- o ácido conjugado é a espécie que resulta após a base formar uma ligação a H (por exemplo , piridínio, que tem uma nova ligação N–H)
- o ácido é a espécie que perde H+ . É onde a ligação a H quebra (e.g. H-Cl)
- a base conjugada é a espécie que permanece após o ácido doar h+ à base (por exemplo, Cl-)
Aqui está piridina e piperidina em ação. Seguindo as ligações que formam e quebram, você pode identificar cada ator.
2. Usando o pKa para medir a acidez
cada reação ácido-base pode ser escrita como um equilíbrio entre uma reação frontal e reversa. Vimos que a constante de acidez, Ka, é uma medida da facilidade com que uma espécie se dissocia para dar H+ e a base conjugada.
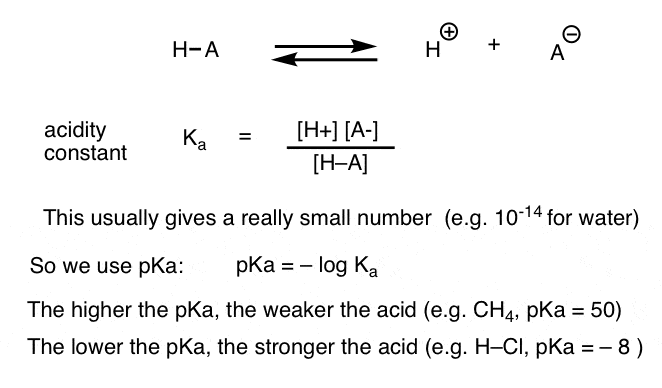
Para sua conveniência, utilizamos o registro negativo do Ka, chamado de pKa, que é semelhante ao familiar escala de pH, mas pode se estender além de 14 porque não é estritamente limitada à aquosa de solvente. os valores de pKa variam entre -10, aproximadamente, para ácidos muito fortes (por exemplo, ácido hidroiodico, H–I), e 50, ou mais, para certos hidrocarbonetos (por exemplo, etano).como podemos aplicar estes conceitos para medir a basicidade? Não poderíamos mudar as coisas e definir um termo, Kb, que é o equilíbrio para quão prontamente uma espécie se combina com H+ , definir pKb como seu log negativo, e comparar bases olhando para seus valores pKb?
Sim…. podíamos. Acho que sim. Se fosse preciso. Mas, geralmente, a opinião dos químicos orgânicos sobre este assunto é “Parafuso pKb”.apesar de tudo, os valores de pKa foram medidos para milhares de moléculas orgânicas. Alguém realmente quer ter que se lembrar de um enorme conjunto de valores pKb também? Claro que não!em vez disso, podemos usar facilmente os valores de pKa como medida indirecta da basicidade. Eis como.
3. Usando os valores de pKa para quantificar a basicidade das aminas
recordar estas duas linhas imortais de prosa, vale a pena recitar para si mesmo todas as noites:
- Quanto mais forte o ácido, mais fraca a base conjugada.quanto mais fraco o ácido, mais forte a base conjugada.foi medida a pKa para o ácido conjugado da piridina (piridínio). É cerca de 5.2 .
também temos um valor para o pKa para o ácido conjugado da piperidina. São cerca de 11 .
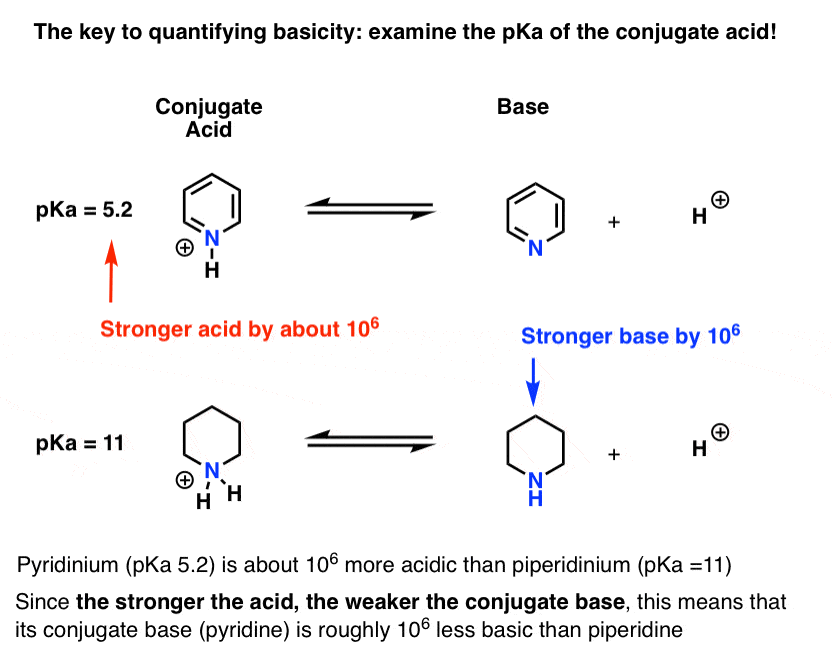
a Partir destes valores de pKa, podemos dizer que o ácido conjugado de nucleotides é mais forte do que o ácido conjugado da piperidina por cerca de 6 unidades de pKa. Uma vez que cada unidade pKa representa um fator de 10, Isso é um fator de cerca de 1 milhão.uma vez que” quanto mais forte o ácido, mais fraco a base conjugada”, piridina é, portanto, uma base mais fraca do que a piperidina por um fator de 1 milhão.4. “O pKa do ácido conjugado “pode ser abreviado como”pKaH ”
o termo,” pKa do ácido conjugado ” é um pouco de um mouthful para usar em uma base regular. Sendo naturalmente preguiçosos, gostaríamos de condensar isto um pouco para uso comum.
Uma vez que o ácido conjugado de uma base (“B”) é “BH”, podemos abreviar “o pKa do ácido conjugado de uma base” como seu pKaH.Isto permite-nos dizer que o pKaH da piridina é 5,2, e o pKaH da piperidina é 11.
Podemos então escavar na literatura para encontrar outras bases para compará-la.
por exemplo, como é que o amoníaco é básico (NH3) ? O ácido conjugado de amônia, NH4 (+), é 9,2 . Da mesma forma, podemos dizer que o pKaH de amônia é 9,2. Isto coloca-o entre a piridina e a piperidina na escala de basicidade.
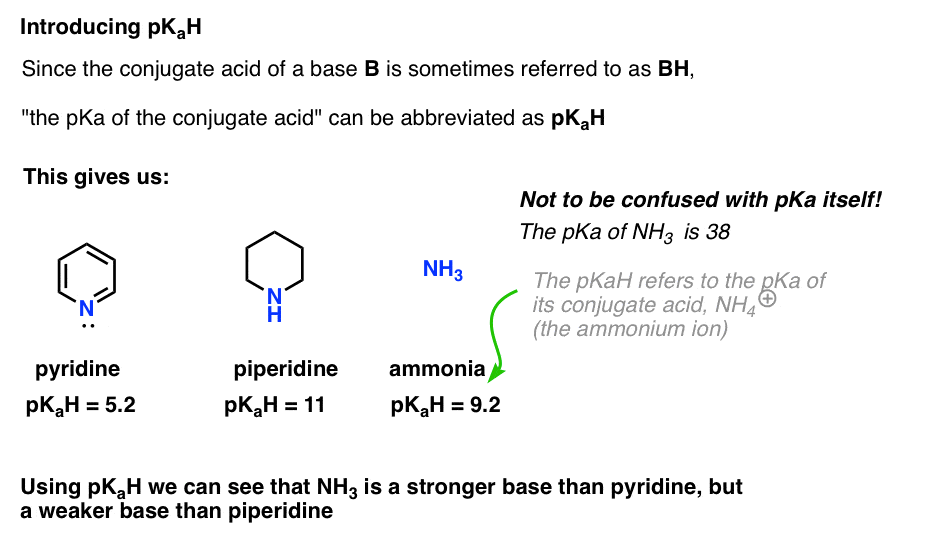
Note que é muito importante não confundir pKaH com valores de pKa. O pKaH de amônia é 9,2, que mede a acidez do ácido conjugado, NH4(+).
o pKa de amônia em si é 38, O que mede a constante de equilíbrio para dissociação de NH3 para dar sua base conjugada, NH2(-) e H+.isso significa que 38 é o pKaH do íon amida NH2 (–), que você pode ter encontrado antes como a base forte (NaNH2) usada para desprotonar alcynes terminais (pKa =25). Usando pKaH, podemos determinar que NH2 (–) é cerca de (38 – 9) = 29 ordens de magnitude mais básicas do que NH3 !
5. Usar o pKaH para determinar as Basicidades relativas das aminas
Usando o pKaH para determinar as forças relativas das bases é um truque bastante útil.
Aqui estão alguns exemplos representativos de moléculas contendo nitrogênio. Abaixo está o pKa de seus ácidos conjugados.qual é a base mais forte aqui? Qual é o mais fraco?
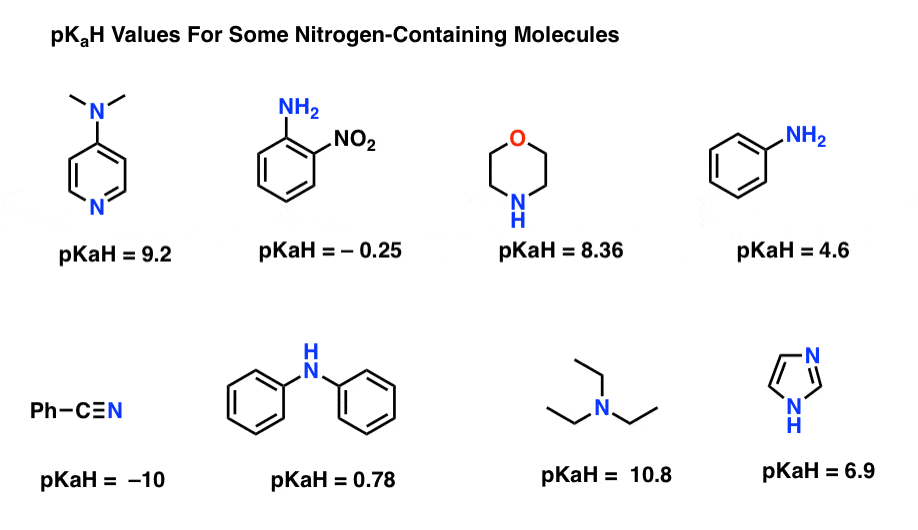
O menor pKaH valor aqui é de -10 para o nitrílica (canto inferior esquerdo). Isto significa que o nitrilo é o menos básico de todas estas moléculas.
O valor mais elevado de pKaH aqui é de 10, 8 para a trietilamina. Isso faz da trietilamina a base mais forte de todas as listadas.
algumas palavras de precaução sobre os valores de pKa para aminas
duas coisas a ter em atenção, especialmente ao ler outras fontes online sobre este tópico.em primeiro lugar , por vezes, os valores de pKaH para as aminas são reportados como valores de pKa, sem explicação. As melhores mesas de pKa não fazem isso, mas é difícil separar o trigo do joio quando você está apenas começando.se vir um valor anormalmente baixo de pKa para uma amina, é provável que se refira ao pKaH do ácido conjugado.
por exemplo, aqui está uma tabela pKa onde o pKa de metilamina (CH3NH2) está listado como 10.63.isso é baixo. Esperançosamente por este ponto, tal valor de 10 para um pKa de um amine deve lhe parecer estranho, especialmente desde que o pKa do intimamente relacionado NH3 é 38.
o valor de 10.63 na verdade refere-se ao pKa do ácido conjugado da metil-Amina, e não à metilamina em si. É um valor pKaH.da mesma forma, a mesma tabela lista a trimetilamina como tendo um pKa de 9,8 . Mais uma vez, este é o seu pakah. Eu não consigo encontrar um valor real de pKa para trimetilamina, mas eu diria que é >40, uma vez que a base conjugada de trimetilamina é o carbanion (CH3)2N–CH2(–) ).
a second, less common source of confusion is that sometimes the pKaH of an amine is reported as its pKb, such as in this table which reports the pKb of NH3 as 9.2 . Isto é impreciso.
novamente, os valores de pKb realmente não surgem muito em Química Orgânica de graduação, embora me digam que eles às vezes fazem uma aparição no DAT/MCAT.
7. Que Factores-Chave Governam A Basicidade Das Aminas?
Agora que aprendemos pelo menos como quantificar e interpretar os valores de pKa das aminas e seus ácidos conjugados, podemos começar a fazer a pergunta chave: por quê? Que factores-chave governam a basicidade das aminas? Quais são as tendências importantes?por exemplo, porque é que a piridina é uma base mais fraca do que a piperidina? Porque é que as nitrilas são bases ainda mais fracas? Por que os grupos de retirada de elétrons tendem a tornar as aminas bases mais fracas?
A boa notícia é que se você já entende os fatores que governam a acidez, você simplesmente tem que aplicar exatamente os mesmos princípios – mas ao contrário!vamos cobrir isso no próximo post. Cinco factores que afectam a basicidade das aminas
notas
Nota de rodapé 1. Existem muitos ácidos que são não-bases (como NH4, que não tem um par solitário) e muitas bases que são não-ácidos, como Cl (–), que é incapaz de aceitar um par solitário. Portanto, dizer “quanto mais forte o ácido, mais fraca a base” é errado.
Nota de rodapé 2. Essa é a medida obtida usando água como solvente. Você pode ver outro valor, 3.4, que é obtido quando o dimetilsulfóxido (DMSO) é usado como um solvente. Ver quadros Bordwell pKa (DMSO)