wspólny efekt jonowy
Nauka > Chemia > Chemia Fizyczna > równowaga jonowa > wspólny efekt jonowy
w tym artykule zbadamy wspólny efekt jonowy i jego zastosowania.
zjawisko, w którym stopień dysocjacji dowolnego słabego elektrolitu jest tłumiony przez dodanie niewielkiej ilości silnego elektrolitu zawierającego wspólny jon, nazywa się wspólnym efektem jonowym.
przykład – 1: (dysocjacja słabego kwasu octowego)
Jonizacja słabego elektrolitu kwasu octowego (CH3COOH)jest tłumiona przez dodanie silnego elektrolitu octanu sodu (CH3COONa)zawierającego wspólny jon octanu (CH3COO–)
Wyjaśnienie:
przypuśćmy, że elektrolitowy kwas octowy (CH3COOH) jest zasilany wodą. Dysocjuje i zachodzi równowaga,
CH3COOH(aq) ⇌CH3COO–(AQ) + H+(AQ)
stosując prawo działania masowego,
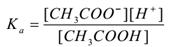
gdzie ” ka ” jest stałą dysocjacji kwasu.
Jeśli do wodnego roztworu CH3COOH zostanie dodana niewielka ilość silnego elektrolitu, takiego jak octan sodu (CH3COONa), ulega dysocjacji i istnieje równowaga, ponieważ
CH3COONa(AQ) → CH3COO–(AQ) + Na+(AQ)
tutaj jony CH3COO są powszechne, stąd ich stężenie wzrasta. Zgodnie z zasadą Le-Chateliera równowaga przesuwa się w lewo. Aby utrzymać stałą wartość Ka, zwiększa się stężenie cząsteczek CH3COOH. W ten sposób jonizacja CH3COOH jest tłumiona przez dodanie CH3COONa. W ten sposób wzrasta pH roztworu.
przykład – 2: (dysocjacja bazy Słabej):
jonizację słabego elektrolitowego wodorotlenku amonowego (NH4OH)tłumi się przez dodanie silnego elektrolitowego chlorku amonowego (NH4Cl) zawierającego wspólny jon amonowy (NH4+)
Wyjaśnienie:
przypuśćmy, że elektrolitowy wodorotlenek amonowy (NH4OH)jest oczyszczany wodą. Dysocjuje i zachodzi równowaga,
NH4OH(aq) ⇌ NH4+(aq) + OH–(AQ)
stosując prawo działania masowego,
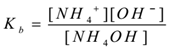
gdzie 'Kb’ jest stałą dysocjacji bazy.
Jeśli do wodnego roztworu NH4OH dodaje się niewielką ilość silnego elektrolitu, takiego jak chlorek amonu (NH4Cl), ulega on dysocjacji i istnieje równowaga, ponieważ
NH4Cl(AQ) → NH4+(aq) + Cl–(AQ)
tutaj jony NH4+ są powszechne, stąd ich stężenie wzrasta. Zgodnie z zasadą Le-Chateliera równowaga przesuwa się w lewo. Aby utrzymać wartość Kb stałą, zwiększa się stężenie cząsteczek NH4OH. W ten sposób jonizacja NH4OH jest tłumiona przez dodanie NH4Cl. W ten sposób zmniejsza się pH roztworu.
zastosowania wspólnego efektu jonowego:
Oczyszczanie soli zwyczajnej:
zasada:
dodanie wspólnego jonu do nasyconego roztworu soli powoduje wytrącanie soli. Gdy iloczyn jonowy przekracza iloczyn rozpuszczalności, następuje wytrącanie.
procesi Wyjaśnienie:
pobiera się nasycony roztwór soli zwyczajnej, wolny od zawieszonych zanieczyszczeń i przepuszcza przez niego Gaz HCl. W nasyconym roztworze nieczystego NaCI równowaga istnieje w następujący sposób,
NaCl(AQ) → na+(AQ) + Cl–(AQ)
Jeśli czysty Gaz HCI przepuszcza się przez ten roztwór, będąc silnym elektrolitem, dysocjuje prawie całkowicie i istnieje równowaga,
HCl(aq) → h+(aq) + Cl–(AQ)
teraz CL– jest wspólnym Jonem. Zwiększa się koncentracja jonów CI (jonów pospolitych). Zgodnie z zasadą Tole-Chateliera równowaga przesuwa się w lewo. Dysocjacja NaCI jest tłumiona, a czysta NaCI jest wytrącana w postaci stałej. Tak więc czysty NaCI może być wytrącony przez przepuszczenie gazu HCI w nasyconym roztworze nieczystego NaCI.
solenie z mydła:
zasada:
dodanie wspólnego jonu do nasyconego roztworu soli powoduje wytrącanie soli. Gdy iloczyn jonowy przekracza iloczyn rozpuszczalności, następuje wytrącanie.
proces i Wyjaśnienie:
mydło to sól sodowa wyższych kwasów tłuszczowych(RCOONa). Jest wytwarzany przez hydrolizę olejów z NaOH. W nasyconym roztworze soap istnieje równowaga,
ROONa(aq) → Rcoo–(AQ) + na+(AQ)
Jeśli do nasyconego roztworu mydła dodaje się niewielką ilość NaCl, dysocjuje ona w postaci
NaCl(AQ) → na+(AQ) + Cl–(AQ)
wzrasta stężenie jonów Na+ (wspólny jon). Ze względu na wspólne działanie jonów, dysocjacja mydła jest zmniejszona i mydło zostaje wytrącone, a następnie może być łatwo usunięte z roztworu mydła. Ten proces uzyskiwania stałego mydła z roztworu mydła, poprzez dodanie soli, takiej jak NaCI, nazywa się soleniem z mydła.