Common Ion Effect
Science > Chemie > Fysische Chemie > Ionische evenwichten > Common Ion Effect
in dit artikel zullen we het gemeenschappelijke Ioneneffect en de toepassingen ervan bestuderen.
het verschijnsel waarbij de dissociatiegraad van een zwakke elektrolyt wordt onderdrukt door toevoeging van een kleine hoeveelheid sterke elektrolyt die een gemeenschappelijk ion bevat, wordt een gemeenschappelijk ion-effect genoemd.
Voorbeeld – 1: (dissociatie van een zwak zuur)
ionisatie van zwak elektrolyt azijnzuur (CH3COOH)wordt onderdrukt door toevoeging van sterk elektrolyt natriumacetaat (CH3COONa)dat veel voorkomende acetaation (CH3COO–)
verklaring:
stel dat een elektrolyt azijnzuur (CH3COOH) wordt gestreeld met water. Het dissocieert en er bestaat een evenwicht zoals volgt,
CH3COOH(aq) ⇌CH3COO–(aq) + H+(aq)
door toepassing van de wet van de massawerking,
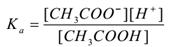
waarbij ” ka ” de dissociatieconstante van zuur is.
als een kleine hoeveelheid van een sterke elektrolyt-achtige natriumacetaat(CH3COONa) wordt toegevoegd aan de waterige oplossing van CH3COOH, wordt het gedissocieerd en bestaat er evenwicht, aangezien
CH3COONa(aq) → CH3COO–(aq) + Na+(aq)
hier CH3COO– ionen gemeenschappelijk zijn vandaar dat hun concentratie toeneemt. Volgens het principe van Le-Chatelier verschuift het evenwicht naar links. Om de waarde van Ka constant te houden, wordt de concentratie van CH3COOH moleculen verhoogd. Op deze manier wordt de ionisatie van CH3COOH onderdrukt door toevoeging van CH3COONa. Zo neemt de pH van de oplossing toe.
Voorbeeld – 2: (dissociatie van een WeakBase):
ionisatie van zwak elektrolytammoniumhydroxide (NH4OH)wordt onderdrukt door toevoeging van sterk elektrolytammoniumchloride (NH4Cl) met veelvoorkomend ammoniumion (NH4+)
verklaring:
stel dat een Elektrolytammoniumhydroxide (NH4OH)met water wordt behandeld. Distantieert en een evenwicht existsas volgt,
NH4OH(aq) ⇌ NH4+(aq) + OH–(aq)
Door de toepassing van de wet van massa-actie,
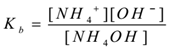
Waar ‘Kb’ is de dissociatieconstante van het basisstation.
als een kleine hoeveelheid sterk elektrolyt zoals ammoniumchloride(NH4Cl) wordt toegevoegd aan de waterige oplossing van NH4OH, wordt het gedissocieerd en bestaat er evenwicht, aangezien
NH4Cl(aq) → NH4+(aq) + Cl–(aq)
hier NH4+ – ionen gemeenschappelijk zijn vandaar dat hun concentratie toeneemt. Volgens het principe van Le-Chatelier verschuift het evenwicht naar links. Om de waarde van Kb constant te houden, wordt de concentratie van NH4OH moleculen verhoogd. Op deze manier wordt de ionisatie van NH4OH onderdrukt door toevoeging van NH4Cl. Zo neemt de pH van de oplossing af.
toepassingen van gemeenschappelijk Ioneneffect:
zuivering van zout:
Principe:
toevoeging van zoution aan een verzadigde zoutoplossing veroorzaakt neerslag van zout. Wanneer het Ionische product het oplosbaarheidsproduct overschrijdt, vindt neerslag plaats.
proces en uitleg:
een verzadigde oplossing van gewoon zout, vrij van gesuspendeerde onzuiverheden wordt genomen en HCl-gas wordt erdoorheen geleid. In een verzadigde oplossing van onzuivere Naki bestaat evenwicht als volgt:
NaCl(aq) → Na+(aq) + Cl–(aq)
als zuiver HCI gas door deze oplossing wordt geleid, als sterke elektrolyt, dissocieert het vrijwel volledig en evenwicht bestaat,
HCl(aq) → H+(aq) + Cl–(aq)
nu is Cl– een gemeenschappelijk ion. De concentratie van CI-ionen (gemeenschappelijke ionen) wordt verhoogd. Volgens toLe-Chatelier ‘ s Principe evenwicht verschuift naar links. De dissociatie van Naki wordt onderdrukt en zuivere Naki wordt neergeslagen als vast zout. Aldus kan zuivere NaCI worden neergeslagen door HCI gas in de verzadigde oplossing van onzuivere Naci door te geven.
zouten uit zeep:
Principe:
de toevoeging van gemeenschappelijke ionen aan een verzadigde zoutoplossing veroorzaakt de neerslag van zout. Wanneer het Ionische product het oplosbaarheidsproduct overschrijdt, vindt neerslag plaats.
proces en uitleg:
zeep is natriumzout van hogere vetzuren (RCOONa). Het wordt bereid door hydrolyse van oliën met NaOH. In verzadigde zeepoplossing bestaat er een evenwicht,
ROONa(aq) → RCOO–(aq) + Na+(aq)
als een kleine hoeveelheid NaCl wordt toegevoegd aan de verzadigde zeepoplossing, wordt deze losgemaakt als
NaCl(aq) → Na+(aq) + Cl–(aq)
concentratie van Na+ ionen (gewoon ion) toeneemt. Door het gemeenschappelijke ioneneffect wordt de dissociatie van zeep verminderd en zeep wordt neergeslagen en kan vervolgens gemakkelijk uit de zeepoplossing worden verwijderd. Dit proces van het verkrijgen van vaste zeep uit zeepoplossing, door het toevoegen van zout zoals Naki wordt zouten uit zeep genoemd.