Chemieleerder
Wat is een Coördinaatcovalente binding?
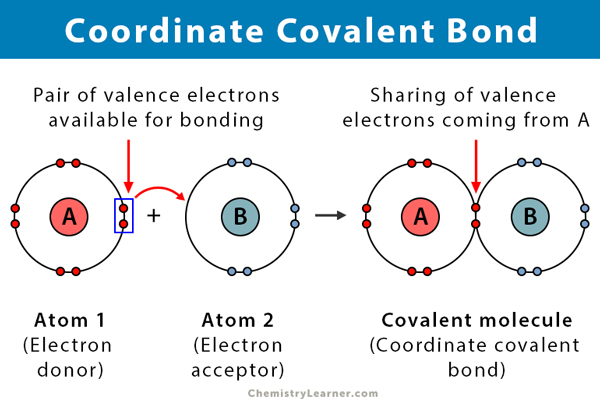
een covalente binding wordt gevormd wanneer twee atomen elektronen delen. Een coördinaatcovalente binding, ook bekend als een datieve covalente binding, is een type covalente binding waarin het gedeelde paar elektronen afkomstig is van een van de atomen. De atomen worden bij elkaar gehouden omdat beide kernen het elektronenpaar aantrekken. Zodra de covalente binding is gevormd, is het onmogelijk om de oorsprong van de elektronen te onderscheiden. Dit soort binding wordt meestal waargenomen in de binding van metaalionen aan liganden. Niet-metalen kunnen echter ook deelnemen aan deze binding. De reactie tussen Lewis zuur en base is een coördinaat covalente binding .
een complex ion bestaat uit twee dingen, een metaalion en verbindingen die liganden worden genoemd. Liganden zijn neutrale moleculen of ionen die eenzame elektronenparen bevatten die zich met het metaalion kunnen binden. Veel voorkomende liganden zijn ammoniak (NH3), water (H2O) en halogenide– ionen (Cl–, Br -). Liganden worden beschouwd als Lewis bases omdat ze hun elektronenparen delen met het metaalion. Metaalionen zijn altijd positief, dus ze zijn heel aantrekkelijk voor eenzame paren elektronen.
feiten en eigenschappen van Coördinaatcovalente binding
De coördinaatcovalente binding heeft veel overeenkomsten met die van covalente binding. Hier zijn enkele van zijn eigenschappen:
- vindt plaats tussen een elektrondonor en een elektronacceptor, typisch tussen een metaal en een ligand
- vindt plaats tussen ongelijksoortige atomen
- gevormd door het delen van elektronen gedoneerd door een van de atomen
- rigide en directionele
- polaire
- volgens de octetregel
- het atoom dat de elektronen doneert wordt een donor genoemd, en het atoom dat ze accepteert wordt een acceptor genoemd.
- verbindingen zijn weinig oplosbaar in water
voorbeelden van Coördinaatcovalente binding
Hier zijn enkele voorbeelden van moleculen waar coördinaatcovalente binding bestaat .
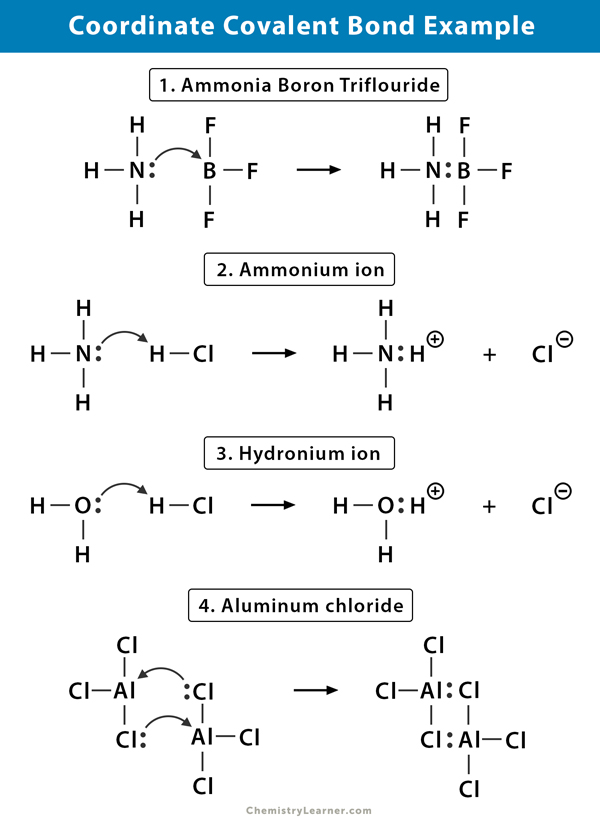
Ammonium (NH4+) ion
het ammoniumion wordt gevormd uit de reactie van ammoniakgas (NH3) met waterstofchloridegas (HCl). In NH4+ is de vierde waterstof verbonden door een covalente binding, omdat alleen de kern van de waterstof wordt overgedragen van het chloor naar de stikstof. Het elektron van de waterstof wordt achtergelaten op het chloor om een negatief chloride (Cl–) ion te vormen.
ammoniak Boriumtrifluoride (NH3.BF3)
Boriumtrifluoride (BF3) is een verbinding die geen edelgasstructuur rond het Boor (B) – atoom heeft. Het boor heeft slechts drie paar elektronen in zijn valantieschil en heeft een paar nodig om de baan te voltooien. Daarom is BF3 elektronendeficiënt. Het eenzame paar op de stikstof (N) van de ammoniak (NH3) molecuul wordt gebruikt om dat tekort te overwinnen, en een complexe verbinding vormt door een coördinaat covalente binding.
Hydroniumion (H3O+)
wanneer waterstofchloridegas (HCl) oplost in water tot zoutzuur (HCl aq.), een coördinaat covalente binding wordt gevormd in het hydronium ion. De waterstofkern (h) wordt overgebracht naar het watermolecuul (H2o), dat een enkel paar elektronen heeft om hydronium te vormen. H draagt dus geen elektronen bij aan de binding.
aluminiumchloride (Al2Cl6)
de binding in aluminiumchloride (AlCl3) is in wezen covalent. Elk aluminium (Al) atoom heeft een tekort van twee elektronen in zijn valance shell, en chloor (Cl) heeft een eenzaam paar. Al vormt een coördinaat covalente binding met het CL-atoom op een aangrenzende AlCl3-groep. Aangezien elk van twee al-atomen dit doet, is aluminiumchloride een covalent dimeermolecuul met de formule Al2Cl6.
koolstofmonoxide (CO)
koolstof (C) heeft vier elektronen in zijn valentieschil, en zuurstof (O) heeft zes. Zowel koolstof als zuurstof delen hun twee elektronen. Terwijl de octetregel tevreden is met zuurstof, is er nog steeds een tekort van twee elektronen op de koolstof. Zuurstof deelt dus zijn twee elektronen met koolstof om een coördinatencovalente binding te vormen, naast de twee reguliere (dubbele) covalente bindingen.