basiciteit van aminen en pKaH
die de basiciteit van aminen kwantificeert, gebruikmakend van “de pKa van het geconjugeerde zuur”, ook bekend als”pKaH”
Hoe meet je de basiciteit van een amine? Voorbeeld: Wat is een sterkere basis: pyridine of piperidine?
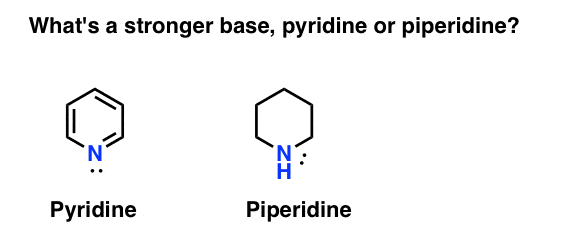
Als u piperidine zei, gefeliciteerd – het is inderdaad een sterkere base.
maar waarom? En hoeveel sterker? Hoe probeer je deze vragen te beantwoorden? We kunnen de sterkte van zuren immers gemakkelijk vergelijken door hun pKa ‘ s te onderzoeken. zouden we niet in staat moeten zijn om hetzelfde te doen met basen?
Ja, in zekere zin. Hier zijn twee belangrijke punten voor vandaag:
- de beste manier om de basiciteit van een amine te kwantificeren is door de pKa van zijn geconjugeerde zuur te onderzoeken.
- hoe hoger de pKa van het geconjugeerde zuur, hoe sterker de base.
In dit bericht zullen we enkele specifieke voorbeelden laten zien van het gebruik van pKa-waarden om de basiciteit van amines te vergelijken.
in een volgend bericht zullen we enkele belangrijke trends onderzoeken die ten grondslag liggen aan de basiciteit van amines.
inhoudsopgave
- snel overzicht: zuren, basen, geconjugeerde zuren en geconjugeerde basen
- gebruik makend van pKa om de zuurgraad te meten
- gebruik makend van pKa om de basiciteit van aminen te kwantificeren
- de “pKa van het geconjugeerde zuur” kan worden afgekort als “pKaH”
- gebruik makend van pKaH om de relatieve Basiciteiten van aminen
- te bepalen welke sleutelfactoren bepalen de basiciteit van aminen op de pKa-waarden voor aminen
- ?
- opmerkingen
1. Snelle Beoordeling: Zuren, basen, geconjugeerde zuren en geconjugeerde basen
laten we eerst snel een aantal basiciteitsbasissen bekijken.
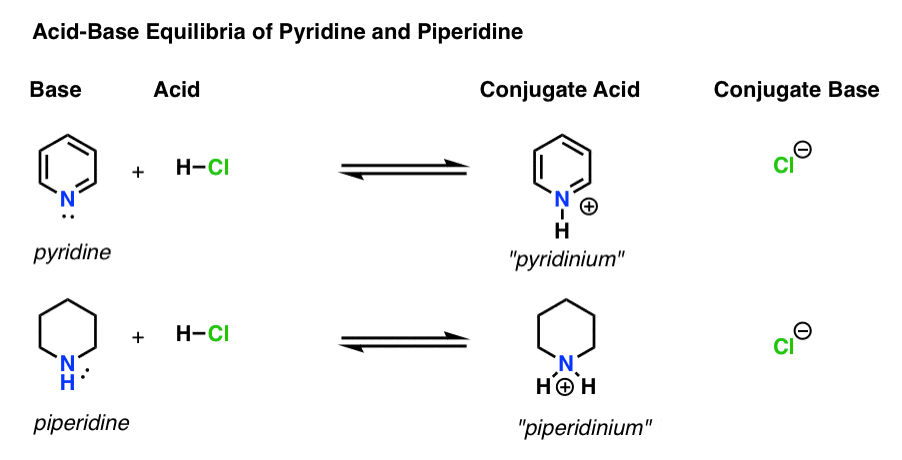
Er zijn vier actoren in elke zuur-base reactie.
- de basis is de soort die een enkel paar doneert aan H+ (ook bekend als een” proton “of”waterstofkern”). Het is waar de nieuwe binding met H ontstaat (bv. pyridine, hieronder)
- het geconjugeerde zuur is de soort die ontstaat nadat de base een binding met H vormt (bv. “pyridinium” , dat een nieuwe N–H binding heeft)
- het zuur is de soort die h+ verliest . Het is waar de band met H breekt (bijv. H-Cl)
- de geconjugeerde base is de soort die overblijft nadat het zuur H+ aan de base doneert (bijvoorbeeld Cl-)
Hier zijn pyridine en piperidine in werking. Door de bindingen te volgen die vormen en breken, kunt u elke actor identificeren.
2. Met behulp van pKa om de zuurgraad
te meten kan elke zuur-base reactie worden geschreven als een evenwicht tussen een vooruit-en een omgekeerde reactie. We hebben gezien dat de zuurtegraadconstante, Ka, Een maat is voor hoe gemakkelijk een soort dissocieert om H+ en de geconjugeerde base te geven.
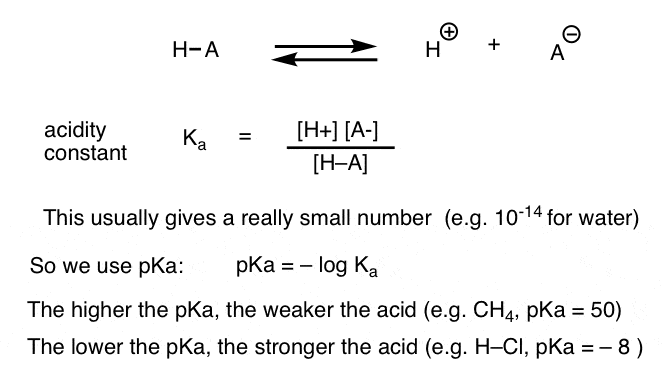
voor het gemak gebruiken we de negatieve log van Ka, genaamd pKa, die vergelijkbaar is met de bekende pH-schaal, maar kan groter zijn dan 14 omdat het niet strikt beperkt is tot waterig oplosmiddel. pKa-waarden variëren van -10 of zo voor zeer sterke zuren (bv. hydroiodinezuur, H-I) tot 50 en meer voor bepaalde koolwaterstoffen (bv. ethaan).
Hoe kunnen we deze concepten toepassen om basiciteit te meten? Kunnen we niet omschakelen en een term definiëren, Kb, wat het evenwicht is voor hoe gemakkelijk een soort combineert met H+ , PKB definiëren als zijn negatieve log, en basissen vergelijken door te kijken naar hun pKb-waarden?
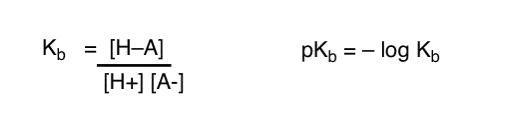
Ja…. dat kunnen we. Ik denk het. Als het moest. Maar over het algemeen is de mening van organische chemici over dit onderwerp “schroef pKb”.
per slot van rekening zijn pKa-waarden gemeten voor duizenden organische moleculen. Wil iemand ook echt een enorme set pKb-waarden onthouden? Echt niet!
in plaats daarvan kunnen we PKA-waarden eenvoudig gebruiken als een indirecte meting van basiciteit. Dit is hoe.
3. Gebruik pKa-waarden om de basiciteit van Amines te kwantificeren
herinner deze twee onsterfelijke prozalijnen, die het waard zijn om elke nacht aan jezelf te reciteren:
- hoe sterker het zuur, hoe zwakker de geconjugeerde base.
- hoe zwakker het zuur, hoe sterker de geconjugeerde base.
de pKa voor het geconjugeerde zuur van pyridine (“pyridinium”) is gemeten. Het is ongeveer 5,2 .
we hebben ook een waarde voor de pKa voor het geconjugeerde zuur van piperidine. Het is ongeveer 11 uur .
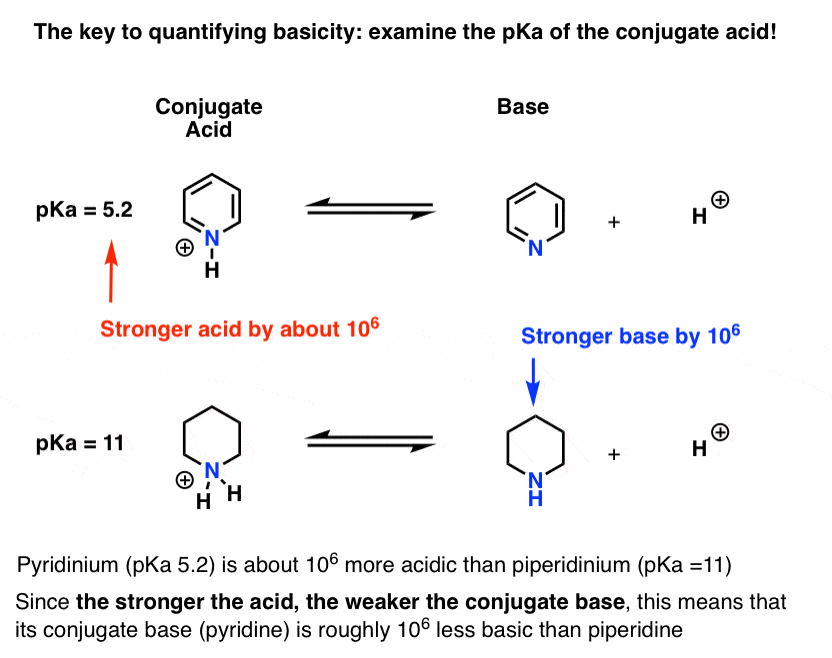
uit deze PKA waarden kunnen we zien dat het geconjugeerde zuur van pyridine sterker is dan het geconjugeerde zuur van piperidine door ongeveer 6 PKA eenheden. Aangezien elke PKA-eenheid een factor 10 vertegenwoordigt, is dat een factor van ongeveer 1 miljoen.
aangezien “hoe sterker het zuur, hoe zwakker de geconjugeerde base”, is pyridine een factor 1 miljoen zwakker base dan piperidine.
4. “De pKa van het geconjugeerde zuur “kan worden afgekort als”pKaH”
De term “pKa van het geconjugeerde zuur” is een beetje een mondvol om regelmatig te gebruiken. Omdat we van nature lui zijn, willen we dit graag een beetje condenseren voor algemeen gebruik.
aangezien het geconjugeerde zuur van een base (“B”) “BH” is, kunnen we “de pKa van het geconjugeerde zuur van een base” afkorten als zijn pKaH.
Dit laat ons zeggen dat de pKaH van pyridine 5.2 is, en de pkah van piperidine 11.
we kunnen dan in de literatuur graven om andere bases te vinden om het mee te vergelijken.
bijvoorbeeld, hoe basisch is ammoniak (NH3) ? Het geconjugeerde zuur van ammoniak, NH4 (+), is 9,2 . Gelijkwaardig kunnen we zeggen dat de pKaH van ammoniak 9.2 is. Dit zet het tussen pyridine en piperidine op de basiciteitsschaal.
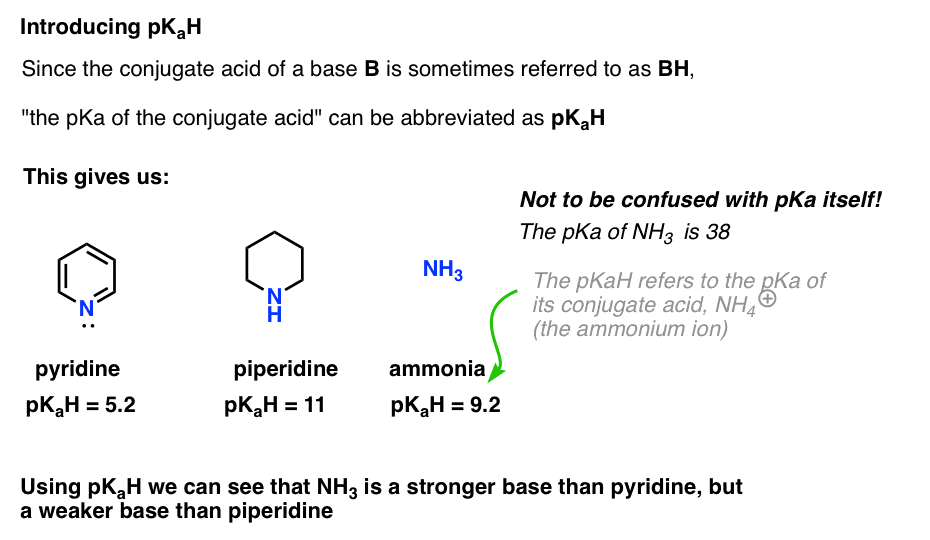
merk op dat het erg belangrijk is om pKaH niet te verwarren met pKa. De pKaH van ammoniak is 9.2, die de zuurgraad van het geconjugeerde zuur, NH4 (+) meet.
de pKa van ammoniak zelf is 38, die de evenwichtsconstante voor dissociatie van NH3 meet om zijn geconjugeerde base, NH2(-) en H+te verkrijgen.
dat betekent dat 38 de pKaH is van het amide-ion NH2 ( – ), dat je misschien eerder tegenkwam als de sterke base (NaNH2) die gebruikt werd om eindalkynen te deprotoneren (pKa =25). Met behulp van pKaH kunnen we bepalen dat NH2(–) ongeveer (38 – 9) = 29 ordes van grootte basischer is dan NH3 !
5. PKaH gebruiken om de relatieve Basiciteiten van Amines te bepalen
pKaH gebruiken om de relatieve sterktes van basen te bepalen is een vrij nuttige Truc.
Hier zijn enkele representatieve voorbeelden van stikstofhoudende moleculen. Hieronder is de pKa van hun geconjugeerde zuren.
Wat is hier de sterkste basis? Wat is de zwakste?
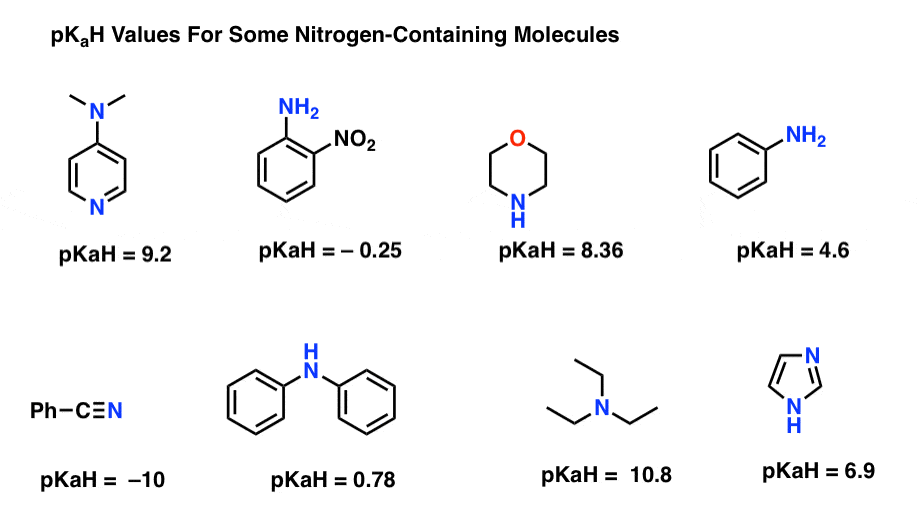
De laagste pKaH-waarde is -10 voor het nitrilzuur (linksonder). Dit betekent dat het nitril de minst fundamentele van al deze molecules is.
de hoogste pKaH-waarde is hier 10,8 voor triethylamine. Dat maakt triethylamine de sterkste base van alle genoemde.
enkele woorden van voorzichtigheid over PKA-waarden voor Amines
twee dingen om op te letten, vooral bij het lezen van andere online bronnen over dit onderwerp.
ten eerste worden de pKaH-waarden voor amines soms gerapporteerd als pKa-waarden , zonder uitleg. De beste PKA tafels zullen dit niet doen, maar het is moeilijk om het koren van het kaf te sorteren als je net begint.
als je een abnormaal lage pKa-waarde voor een amine ziet, verwijst het waarschijnlijk naar de pKaH van het geconjugeerde zuur.
bijvoorbeeld, hier is een pKa tabel waar de pKa van methylamine (CH3NH2) wordt vermeld als 10.63.
dat is laag. Hopelijk tegen dit punt, zo ‘ n waarde van 10 voor een pKa van een amine moet u als vreemd overkomen, vooral omdat de pKa van de nauw verwante NH3 is 38.
de waarde van 10,63 verwijst eigenlijk naar de pKa van het geconjugeerde zuur van methylamine, niet naar methylamine zelf. Het is een pKaH waarde.
hetzelfde geldt voor trimethylamine met een pKa van 9,8 . Nogmaals, dit is eigenlijk zijn pKaH. Ik kan geen echte pKa-waarde vinden voor trimethylamine, maar ik denk dat het >40 is, aangezien de geconjugeerde base van trimethylamine het carbanion (CH3)2N–CH2 (–) is.
een tweede, minder voorkomende bron van verwarring is dat soms de pKaH van een amine als zijn pKb wordt gerapporteerd, zoals in deze tabel die de pKb van NH3 als 9.2 rapporteert . Dit is onjuist.
nogmaals, pKb waarden komen niet echt hoog in de undergraduate organische chemie, hoewel mij is verteld dat ze soms een verschijning op de dat/MCAT.
7. Welke Sleutelfactoren Bepalen De Basiciteit Van Amines?
nu we tenminste hebben geleerd hoe we de pKa-waarden van aminen en hun geconjugeerde zuren kunnen kwantificeren en interpreteren, kunnen we beginnen met de belangrijkste vraag te stellen: waarom? Welke sleutelfactoren bepalen de basiciteit van amines? Wat zijn de belangrijkste trends?
bijvoorbeeld, waarom is pyridine een zwakkere base dan piperidine? Waarom zijn nitrillen nog zwakkere basen? Waarom hebben elektron terugtrekkende groepen de neiging om amines zwakkere basen te maken?
het goede nieuws is dat als je de factoren die de zuurgraad bepalen al begrijpt, je gewoon exact dezelfde principes moet toepassen – maar omgekeerd!
We zullen dat in het volgende bericht behandelen. Vijf factoren die van invloed zijn op de basiciteit van Amines
noten
voetnoot 1. Er zijn veel zuren die niet-basen zijn (zoals NH4 dat een eenzaam paar mist) en veel basen die niet-zuren zijn, zoals Cl (–), die niet in staat is om een eenzaam paar te accepteren. Vandaar, zeggen “hoe sterker het zuur, hoe zwakker de base” is verkeerd.
voetnoot 2. Dat is de meting verkregen met water als oplosmiddel. Je zou een andere waarde kunnen zien, 3.4, die wordt verkregen wanneer dimethylsulfoxide (DMSO) wordt gebruikt als oplosmiddel. Zie Bordwell pKa tabellen (DMSO)