Felles Ion Effekt
Vitenskap > Kjemi > Fysisk Kjemi > Ioniske Likevekter > Felles Ion Effekt
i denne artikkelen skal vi studere Den Vanlige Ioneffekten og dens applikasjoner.
fenomenet der graden av dissosiasjon av en svak elektrolytt undertrykkes ved å legge til en liten mengde sterk elektrolytt som inneholder en felles ion kalles en felles ioneffekt.
Eksempel – 1: (Dissosiasjon Av En Svaksyre)
Ionisering av svak elektrolytteddiksyre (CH3COOH)undertrykkes ved å tilsette sterk elektrolyttnatriumacetat (CH3COONa)som inneholder vanlig acetation (CH3COO–)
Forklaring:
Anta at en elektrolytteddiksyre (CH3COOH) behandles med vann. Det dissosierer og en likevekt eksisterersom følger,
CH3COOH(aq) ⇌CH3COO–(aq) + H+(aq)
ved å anvende loven om massehandling,
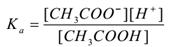
hvor ‘ka’ ER DISSOSIASJONSKONSTANTEN av syre.
HVIS en liten mengde av en sterk elektrolytt som natriumacetat (CH3COONa) tilsettes TIL DEN vandige oppløsning AV CH3COOH, det blir dissosiert og likevekt eksisterer, som
ch3coona(aq) → CH3COO–(aq) + Na+(aq)
HER CH3COO– ioner er vanlig dermed deres konsentrasjon øker. Ifølge Le-Chateliers prinsipp skifter likevekt mot venstre. For å holde Verdien Av Ka konstant, øker konsentrasjonen AV ch3cooh molekyler. På denne måten undertrykkes ioniseringen AV CH3COOH ved å tilsette CH3COONa. Dermed øker ph i løsningen.
Eksempel-2: (Dissosiasjon Av En WeakBase):
Ionisering av svakt elektrolyttammoniumhydroksid (NH4OH)undertrykkes ved å tilsette sterk elektrolyttammoniumklorid (NH4Cl) inneholdende vanlig ammoniumion (NH4+)
Forklaring:
Anta at et elektrolyttammoniumhydroksyd (NH4OH)behandles med vann. DET dissosierer og en likevekt eksisterersom følger,
NH4OH(aq) ⇌ NH4+(aq) + OH–(AQ)
ved å anvende loven om massehandling,
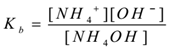
hvor ‘kb’ er dissosiasjonskonstanten av basen.
Hvis en liten mengde sterk elektrolytt som Ammoniumklorid (NH4Cl) tilsettes TIL DEN vandige LØSNINGEN AV NH4OH, blir den dissosiert og likevekt eksisterer, da
NH4Cl(aq)+Cl–(Aq)
HER NH4 + ioner er vanlige, og dermed øker konsentrasjonen. Ifølge Le-Chateliers prinsipp skifter likevekt mot venstre. For å holde Verdien Av Kb konstant, øker KONSENTRASJONEN AV NH4OH molekyler. På denne måten undertrykkes ionisering AV NH4OH ved å tilsette NH4Cl. Dermed reduseres ph i løsningen.
Anvendelser Av Felles Ion Effekt:
Rensing Av Vanlig Salt:
Prinsipp:
tilsetningen av vanlig ion til en mettet saltoppløsning forårsaker utfelling av salt. Når det ioniske produktet overstiger løselighetsproduktet, finner utfelling sted.
Prosessog Forklaring:
en mettet løsning av vanlig salt, fri frasuspenderte urenheter er tatt og HCl-gass føres gjennom den. I en mettet Løsning av uren NaCI eksisterer likevekt som følger,
nacl(aq) → Na+(aq) + Cl–(aq)
hvis ren HCI–gass føres gjennom denne løsningen, er sterk elektrolytt, dissosierer den nesten helt og likevekt eksisterer,
HCl(aq) → H+(aq) + Cl– (aq)
Nå Er Cl-en vanlig ion. Konsentrasjonen AV CI-ioner (vanlige ioner) økes. Ifølge Tole-Chateliers prinsipp skifter likevekt mot venstre. Dissosiasjon Av NaCI er undertrykt og ren NaCI utfelles som solidsalt. Således kan ren NaCI utfelles ved å sende HCI-gass imettet løsning av uren NaCI.
Salting Ut Av Såpe:
Prinsipp:
tilsetningen av vanlig ion til en mettet saltoppløsning forårsaker utfelling av salt. Når det ioniske produktet overstiger løselighetsproduktet, finner utfelling sted.
Prosessog Forklaring:
Såpe er natriumsalt av høyere fettsyrer (RCOONa). Den fremstilles ved hydrolyse av oljer Med NaOH. I saturatedsåpeoppløsning finnes det en likevekt,
roona(aq) → rcoo–(aq) + Na+(aq)
hvis en liten mengde NaCl tilsettes til den mettede såpeoppløsningen, blir Den dissosiert som
nacl(aq) → Na+(aq) + Cl–(aq)
Konsentrasjonen Av Na+ ioner (vanlig ion) øker. På grunn av den vanlige ioneffekten reduseres dissosiasjonen av såpe og såpe blir utfelt og kan lett fjernes fra såpeoppløsningen. Denne prosessen med å få fast såpe fra såpeoppløsning, ved å tilsette salt som NaCI kalles salting ut av såpe.