Design AV FRET-TaqMan prober for multiplex real-time PCR ved hjelp av en intern positiv kontroll
Introduksjon
Real-time PCR muliggjør kontinuerlig overvåking av fluoroforfluorescens under generering AV PCR-produkter i et lukket rørformat. For tiden bruker tilgjengelige metoder enten merkede prober eller DNA-interkalerende fargestoff for å overvåke forsterkningen AV PCR-produktet. TaqMan-sonden er et enkeltstrenget oligonukleotid som inneholder en fluorofor og quencher plassert 10-30 baser fra hverandre. Taqman-sonden hydrolyseres under forsterkningen på grunn av den 5′ -3 ‘ dobbeltstrengspesifikke eksonukleaseaktiviteten Til Taq-polymerasen som separerer fluoroforen fra slukkeren, noe som resulterer i fluorescensøkning. Sanntids PCR-instrumenter er utstyrt med fluorescensdetektorer og programvare som er i stand til å estimere syklusgrensen (Ct), syklusen der fluorescens er større enn bakgrunnsfluorescens, for positive reaksjoner. Teknikken kan imidlertid ikke skille et sant negativt resultat fra et falskt negativt når PCR påvirkes av amplifikasjonshemmere. Etter nukleinsyreutvinning er det rapportert at inhibitorer fortsatt kan være tilstede fra kliniske prøver (f.eks. hemoglobin), miljøprøver (f. eks. humic og fulvic syrer) og kjemikalier som brukes under nukleinsyreutvinning (f. eks. etanol, vaskemidler eller chaotropiske midler). Påliteligheten av diagnostiske analyser økes ved inkludering av en intern kontroll nukleinsyre som kan indikere TILSTEDEVÆRELSE OG påvirkning AV PCR-hemmere (1,2). En intern positiv kontroll (IPC) forsterkes samtidig i nærvær av en målsekvens ved hjelp av en merket fluorofor som avgir lys med en annen bølgelengde enn fluoroforen som brukes til målsekvensanalysen, med de to fluoroforene detektert i forskjellige kanaler av PCR-instrumentet i sanntid. Den vanlige interne kontrollen FOR PCR er et plasmid som inneholder en sekvens som ligner på analysemålet, bortsett fra sondeområdet. ET begrenset antall IPC-molekyler blir tilsatt til det individuelle analysemålet og koforsterkes med målnukleinsyren; dermed er et positivt IPC-signal bevis på at forsterkningsreaksjonen fortsatte tilstrekkelig til å generere et kjøpssignal fra svært små mengder målnukleinsyre. Denne funksjonen er viktig for å sikre ekvivalent forsterkning AV IPC og målnukleinsyren (3-9). Men noen enheter—som LightCycler 1.2 Og LightCycler 2 (Roche Applied Science, Indianapolis, IN, USA), Den Robuste Advanced Patogen Identification Device (R. A. P. I. D.) instrument (Idaho Technology, Salt Lake City, UT, USA) og håndholdte pcr-instrumenter i sanntid-er bare utstyrt med en lyskilde og tilhørende utslippskanal. Multiplexing på disse typer instrumenter krever bruk av multi-merkede oligonukleotider og fluorescens resonans energioverføring (FRET) konseptet. FRETPROBER kan imidlertid være utfordrende å designe og kan mangle robusthet i hypervariable regioner og når ikke-optimale forsterkningsforhold er tilstede. Bruken av FRETPROBER krever identifisering av to regioner for to prober. FRETPROBE-systemet er avhengig av tilstøtende hybridisering av oligonukleotider av de to enkeltmerkede prober på en slik måte at fluorescensen av akseptorfargen detekteres gjennom eksitering av fluoroforen festet til den andre sonden. EN stor ulempe VED FRETPROBEN er kravet om et større sekvensområde som er nødvendig for å imøtekomme to tilstøtende prober med et gap på 2-5 nukleotider. Muligheten finnes for multipleksing med andre etikettsystemer, for eksempel MegaStokes dye (DYXL; Dyomics, Jena, Tyskland) og Pulsar 650 (Biosearch Technologies, Inc., Novato, CA, USA), men disse merkingssystemene krever spektralinformasjon for å kompensere for kanalkryss og er ikke allment tilgjengelige. FRET-TaqMan-sonden utviklet i denne studien krever imidlertid ikke fargekompensasjonsprogramvare og bruker fluoroforer (Fam, Cy5.5) som er allment tilgjengelige. Denne rapporten fokuserer på utformingen av en trippel-merket sonde for å muliggjøre multipleksing i instrumenter utstyrt med bare en blå lysdiode (LED) eksitasjonskilde (470 nm) og tilhørende tre tilsvarende deteksjonskanaler (f.eks. 530 nm, 640 nm og 705 nm).
Materialer og metoder
Probe design prinsipp
alle eksperimenter ble utført På Idaho Technology ‘ S Rap Iid system, en 32-sample bærbar sanntid PCR instrument utstyrt med en blå LED for eksitasjon (470 nm) og tilhørende tre fluorescens deteksjonskanaler som måler fluorescens ved 530, 640 og 705 nm for mono-og dual-farge analyser. Primere JVAF OG JVAR (10) og sonde 5 ‘- FAM / BHQ – 1 ble syntetisert VED CDC Bioteknologi Core Facility (Atlanta, GA, USA) og sonde 5 ‘FAM-Cy5. 5 / 3’ BHQ-3 ble syntetisert Ved Idaho Technology. For å aktivere duplex TaqMan PCR, ble en sonde merket med 5 ‘- FAM / BHQ – 1 (520-nm fluorescens bølgelengde) og en annen med 5 ‘FAM-Cy5. 5 / 3’ BHQ – 3 (705-nm fluorescens bølgelengde). I oppløsning forblir sonden merket med 5 ‘FAM-Cy5. 5 / 3’ BHQ-3 slukket ved hybridisering til en sekvens, og ved etterfølgende spaltning av sonden ved enzymatisk primerforlengelse elimineres quencher. Dette resulterer i FRET gjennom eksitering AV FAM av lyskilden Til R. A. P. I. d. instrumentet. Eksitasjonsenergien overføres til akseptoren fluorofor, Cy5.5, og den utstrålede fluorescens måles i en andre fluorescens kanal (fluorescens kanal F3 For R. A. P. I. d. instrument). Utslipp Av Cy5. 5 fluorescens er et resultat av kombinasjonen AV FRET og TaqMan probe teknikker, slik at disse trippelmerkede prober kan refereres til som «FRET-TaqMan» prober.
Primere, prober og plasmid
for å demonstrere multipleksingskapasiteten TIL FRET-TaqMan-designet, brukte vi en genusspesifikk Cryptosporidium REAL-time PCR-analyse for å forsterke en 159-bp-del AV 18s rRNA-genet (10). Forward primer (JVAF) var 5′-ATGACGGGTAACGGGGAAT-3′, omvendt primer (JVAR) var 5′-CCAATTACAAAAC-CAAAAAGTCC-3′, Og TaqMan sonde (JVAP) var 5′-FAM-CGCGCCTGCT-GCCTTCCTTAGATG-BHQ1–3′, tilsvarende nukleotider 100-118, 258-236, og 184-161, henholdsvis av genbank TILTREDELSE NR. AY458612. Primere for bygging Av Cryptosporidium IPC inneholdt det samme settet av primersekvenser rapportert for forsterkning Av Cryptosporidium spp., bortsett fra probe-bindende regionen av MÅLET DNA, som ble erstattet med kunstig sekvens 5′-TTGTGCTCGTAGTCGCCTCTCTCT-3 ‘ (JPIPC). Denne sondesekvensen hadde en glødetemperatur på 69°C og var designet for å ikke ha noen sekundær struktur. Teoretisk spesifisitet for intern sonde ble fastslått ved ET BLAST (11) søk av sonden og primersekvensene der det ikke ble funnet noe eksakt samsvar med Noen Kryptosporidiumsekvens. IPC-fragmentet ble syntetisert og klonet til et plasmid ved Integrert DNA-Teknologi (Coralville, IA, USA). En kjent konsentrasjon av plasmid-DNA (100 kopier/reaksjon) ble tilsatt i hovedblandingen av alle reaksjoner unntatt i negativ kontroll. En trippelmerket sonde (jpipc) spesifikk FOR IPC ble syntetisert Av Idaho Technology, som vist i Figur 1. FAM/Cy5.5 / BHQ3 oligo-nukleotid sonden ble syntetisert starter på 3’ enden med ikke-fluorescerende Svart Hull Quencher (BHQ-3) kontrollert pore glass (CPG). 5 ‘- enden ble deretter konjugert Med En Cy5. 5 phosporamidite etterfulgt av en terminal 5 ‘ fluorescein (6-FAM) phosporamidite.
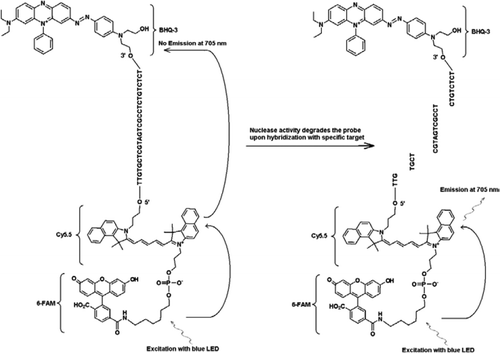
PCR-analyse I Sanntid
Flytcytometri sortert Cryptosporidium parvum oocytter (200 oocytter per rør) hentet fra University Of Wisconsin ‘ S State Laboratory Of Hygiene (Madison, WI, USA). DNA Fra C. parvum oocysts ble ekstrahert ved hjelp av en protokoll beskrevet Av Hill et al. (12) og suspendert i 80 µ Tris EDTA (TE, pH 8.0) buffer. To mikro liter DNA ble tilsatt per reaksjon, som korresponderte med 5 oocytter (tilsvarende 100 kopier av mål-DNA). Forsterkningsreaksjonsblandingen besto Av Quantifast Probe PCR + ROX kit reaksjonsblanding (Cat. nr. 204354; Qiagen) UTEN ROX lagt TIL, JVAF, JVAR primere (0.4 µ hver), JVAP probe (0.2 µ), JPIPC probe (0.2 µ) og 100 eksemplarer av IPC. En aliquot (2 µ) av den ekstraherte DNA-prøven ble tilsatt til reaksjonskapillæren (Roche Diagnostics, Indianapolis, IN, USA) som inneholdt 18 µ reaksjonsblanding. A c. parvum genomisk DNA positiv kontroll (Figur 2, plot 1), plasmid IPC (Figur 2, plot 2), en blanding Av C. parvum positiv kontroll og IPC (Figur 2, plot 3), og EN IKKE-mal kontroll (NTC) bestående av nuklease-fritt vann (Cat. ingen. AM9932; Ambion, Foster City, CA, USA) i stedet FOR DNA (Figur 2, plott 4) ble inkludert i hvert eksperiment. Protokollen tok ∼30 min for å fullføre med FØLGENDE PCR-forhold: hot-start denaturering trinn på 95°C i 3 min, etterfulgt av 45 sykluser med en 95°c denaturering for 5 s, 60°C gløding for 30 s med enkelt fluorescens oppkjøp (med en temperatur rampe rate på 20°C/s). Et positivt resultat ble registrert FOR FAM i kanal F1 (530 nm) og For Cy5.5 i kanal F3 (705 nm). Amplifiseringsreaksjoner ble utført i tre eksemplarer. Amplicons (159 bp) ble visualisert ved agarose gelelektroforese og Glødgrønn nukleinsyrefarging (eEnzyme, Gaithersburg, MD, USA) for å bekrefte SPESIFISITETEN TIL PCR-produktet.
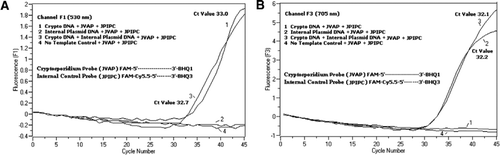
en equimolar blanding AV EN FAM/BHQ1 og EN FAM/Cy5.5/BHQ3 ble tilsatt i ALLE PCR-reaksjonsblandinger. (A) Kanal F1 skjermer økning I fam fluorescens for Tilstedeværelsen Av C. parvum. Plot 1 (kanal F1 samler primært FAM signal) som inneholder Bare C. parvum DNA avslørt Cryptosporidium-spesifikke FAM signal I PCR. Plot 2 inneholdt bare plasmid-DNA og ingen FAM-signal fra fam/Cy5.5 / BHQ3-sonden. Plot 3 inneholdt Både C. parvum OG plasmid DNA, men produserte bare C. parvum-spesifikt FAM-signal. Plot 4 var en negativ prøve som bare inneholdt nukleasefritt vann i stedet for noen mal-DNA; ingen fluorescens ble observert fra probene. (B) Kanal F3 overvåker økning I Cy5. 5 for tilstedeværelse av intern kontroll plasmid DNA. Plot 1 inneholdt Bare C. parvum DNA og ingen fluorescens signal FRA FAM / BHQ1 sonde. Plot 2 (kanal F3 samler Primært Cy5. 5 signal) som inneholder bare plasmid DNA avslørt intern plasmid kontroll (IPC)–spesifikke Cy5.5 signal I PCR. Plot 3 inneholdt Både C. parvum OG plasmid DNA, men produserte BARE IPC-spesifikt Cy5. 5-signal. Plot 4 var en negativ prøve som inneholdt bare nuklease fritt vann i stedet for noen mal DNA; ingen fluorescens ble observert fra sondene.
Resultater og diskusjon
REAL-time PCR-fluorescenssignaler som reflekterer forsterkning Av C. parvum genomisk DNA ble detektert I f1-kanalen (Figur 2a) på GRUNN AV FAM-merking Av TaqMan-sonden. Fluorescenssignal som reflekterer forsterkning AV IPC ble detektert I f3-kanalen (Figur 2b) på GRUNN AV FAM/Cy5.5 merking AV IPC TaqMan-sonden. Denne sonden ga en økning I Cy5.5 I f3-kanalen (Cy5.5), men ingen økning I FAM i F1-kanalen (FAM) når BHQ3 separeres fra FAM/Cy5.5 på grunn av nukleaseaktivitet, fordi energi ble overført fra FAM Til Cy5.5. På samme måte, i dupleksreaksjonen, ble C. parvum genomisk DNA-amplifikasjon detektert I f1-kanalen, MENS IPC-amplifiseringen samtidig ble detektert i f3-kanalen. FAM har en eksitasjon ved 495 nm og en emisjon ved 520 nm. Cy5.5 har en 690 nm eksitasjon og en 705 nm emisjon. Med en slik nærhet Mellom Cy5.5 og FAM på den trippelmerkede IPC-sonden, avgir Cy5.5 fluorofor fluorescens på grunn av fullstendig overføring av energi fra FAM fluoroforen, noe som resulterer i ingen fluorescensutslipp AV FAM i f1-kanalen (Figur 2a). Negative kontrollreaksjoner viste ingen økning i fluorescens på GRUNN AV FAM eller Cy5. 5. Disse resultatene viser også at en enkelt blå (470 nm) LED-kilde er tilstrekkelig til å overvåke to fluorescensutslipp Gjennom f1 (530 nm) og F3 (705 nm) kanaler uten spektral overlapping i de respektive overvåkingskanaler FOR FAM og Cy5.5. FRET-TaqMan-teknikken ble også testet ved hjelp av et panel med 12 DNA-ekstrakter fra avføringsprøver (8 fra prøver som tidligere var bestemt for Å være positive for Cryptosporidium spp. og fire eksemplarer som var negative For Cryptosporidium spp.). 18s rRNA-analysen var i stand til å oppdage alle åtte Cryptosporidium spp. IPC TaqMan-analysen ble funnet å forsterke BARE IPC plasmid-DNA. IPC-analysen resulterte i Ct-verdier på 32-37, noe som indikerte opptil 5 Ct-verdier FOR PCR-hemming for noen avføringsprøver (32 var forventet Ct-verdi for no-inhiberingsreaksjoner).den foreliggende teknikk skiller seg fra tradisjonelt brukt BÅND i at en fluorescently merket oligonukleotid sonde brukes (FRET-TaqMan probe) i stedet for to sonder (FRET prober )der en sonde inneholder donor fluoroforen og den andre sonden inneholder akseptor fluoroforen (13,14). FRET-TaqMan-sonden er merket på 5′ – enden med to fluoroforer av donor (FAM) og akseptor (Cy5.5) fluoroforer og ved 3′ – enden med EN BHQ-3-quencher som En TaqMan-sonde. Den unike sondebindingsregionen er valgt for å skille fra mål-DNA for å overvåke to forskjellige fluorescensmålinger i to forskjellige deteksjonskanaler (530 nm I F1 og 705 nm I F3) fra samme forsterkningsreaksjon uten å måtte inkludere fargekompensasjonsprogramvare. Mål-DNA og IPC hadde de samme primerbindingsstedene, men en annen sondesekvens. Dette sikrer at bruk av de samme primere for BEGGE DNA-mål for å minimere primer-dimer dannelse eller interaksjon mellom primer sett. NÅR FAM / Cy5. 5 fluoroforer er plassert tett på 5 ‘ slutten, finner resonans energioverføring sted med en økning i fluorescens utslipp Av Cy5. 5 fluorofor. BRUK AV BHQ3, en ikke-fluorescensacceptor For Cy5.5, reduserer imidlertid potensiell bakgrunnsfluorescens, noe som resulterer i et høyere signal-til-støyforhold. Det ble funnet at tillegg av 100 kopier AV IPC til en reaksjon som inneholder ∼100 kopier av genomisk C. parvum DNA resulterte i lignende Ct-verdier (Ct = 32) når Cryptosporidium TaqMan-analysen ble utført som en singleplex-analyse og som en tosidig analyse med IPC TaqMan-analysen. NÅR det ble brukt På Et Panel Med Kryptosporidium-positive DNA-prøver, indikerte IPC at noen prøver ikke inneholdt PCR-hemmere (basert på forventede Ct-verdier på 32), men andre prøver var assosiert med hemming av Opptil 5 Ct-verdier.Den nyutviklede interne PCR-positive kontrollen viste seg å være sensitiv og spesifikk for samtidig påvisning av to mål i samme reaksjon på grunn av merkingen MED FAM/Cy5.5-BHQ3 og FAM/BHQ1 for det respektive IPC-og 18s rRNA-målgenet i EN dual-color multiplex PCR for overvåking I F1-og f3-fluorescenskanaler av Rap-instrumentet. Bruken av 5 ‘FAM-Cy5.5 / 3’ BHQ-3–merket sonde som den andre reporteren er fordelaktig fordi utslippsmaksimene til de to sondene var godt avstand fra hverandre. FRET-TaqMan triple-merket probe design kan ha programmer i å utvikle en billig, disponibel» lab-on-a-chip » enhet med optikk bestående av en blå LED eksitasjon og to utslippskilder på 530 nm og 705 nm, med passende optiske filtre for å oppdage FAM i en kanal Og Cy5. 5 i den andre. Denne kombinasjonen ville ikke kreve to kraftige fluorescens kilde og deteksjonssystemer.
Anerkjennelser
forfatterne anerkjenner Hjelp Fra Mike Powers ved DNA-Sekvensering Og Genomisk Kjernefasilitet (University Of Utah, Salt Lake City, UT, USA) og Rachelle Muller ved Idaho Technology, Inc. for diskusjon om utviklingen av den interne positive kontrollen for R. A. P. I. d cycler. Denne publikasjonen ble støttet delvis av midler gjort tilgjengelig gjennom Centers For Disease Control And Prevention, Coordinating Office For Terrorism Preparedness and Emergency Response. Bruk av handelsnavn og kommersielle kilder er kun for identifikasjon og innebærer ikke godkjenning fra Centers for Disease Control and Prevention eller US Department of Health And Human Services.
- 1. Han er en av de eldste i verden. 2005. Utvikling av en ny intern positiv kontroll For Taqman – baserte analyser. Mol. Celle. Sonder 19:51-59.Cas, Google Scholar
- 2. Det er en av de mest kjente artene i verden. 2004. Praktiske hensyn i utformingen av interne amplifikasjonskontroller for diagnostiske PCR-analyser. J. Clin. Mikrobiol. 42:1863–1868.Crossref, Medline, CAS, Google Scholar
- 3. Han er en av de eldste i verden. 2003. Konstruksjon og evaluering av internkontroll-DNA for PCR-forsterkning Av Chlamydia trachomatis DNA fra urinprøver. J. Clin. Mikrobiol. 41:1274–1276.Crossref, Medline, CAS, Google Scholar
- 4. Burggraf, S. Og B. Olgemoller. 2004. Enkel teknikk for intern kontroll av sanntidsforsterkningsanalyser. Clin. Chem. 50:819–825.Crossref, Medline, CAS, Google Scholar
- 5. Han er en av de eldste i verden. 2000. Evaluering av EN NY PCR-analyse med konkurransedyktig internkontrollsekvens for blodgiver screening. Transfusjon 40:718-724.Crossref, Medline, CAS, Google Scholar
- 6. Gruber, F., F. G. Falkner, F. Dorner, Og T. Hammerle. 2001. Kvantifisering av viralt DNA ved sanntids PCR ved bruk av dupleksforsterkning, intern standardisering og tofarget fluorescensdeteksjon. Appl. Miljø. Mikrobiol. 67:2837–2839.Crossref, Medline, CAS, Google Scholar
- 7. Rosenstraus, M., Z. Han er en av de eldste i verden. 1998. En intern kontroll for rutinemessig diagnostisk PCR: design, egenskaper og effekt på klinisk ytelse. J. Clin. Mikrobiol. 36:191–197.Cas, google Scholar
- 8. Stocher, M., V. Leb og J. Berg. 2003. En praktisk tilnærming til generering av flere interne kontroll-DNA for et panel av PCR-analyser i sanntid. J. Virol. Metoder 108: 1-8.Crossref, Medline, CAS, Google Scholar
- 9. Zimmermann, K. Og J. W. Mannhalter. 1996. Tekniske aspekter ved kvantitativ konkurransedyktig PCR. Bioteknologi 21:268-279.Link, CAS, Google Scholar
- 10. I tillegg til å være en av de mest kjente artene i verden, er det også en del av det. 2008. Deteksjon og differensiering Av Cryptosporidium hominis Og Cryptosporidium parvum ved to TaqMan-analyser. J. Med. Mikrobiol. 57:1099–1105.Crossref, Medline, CAS, Google Scholar
- 11. Det er en av de mest kjente artene i verden. 1990. Grunnleggende lokale justering søkeverktøy. J. Mol. Biol. 215:403–410.Crossref, Medline, CAS, Google Scholar
- 12. Det er en av de mest kjente artene i verden. 2007. Multistate evaluering av en ultrafiltreringsbasert prosedyre for samtidig gjenoppretting av enteriske mikrober i 100 liter vannprøver fra springen. Appl. Miljø. Mikrobiol. 73:4218–4225.Crossref, Medline, CAS, Google Scholar
- 13. Bernard, P. S., M. J. Lay og C. T. Wittwer. 1998. Integrert forsterkning OG påvisning AV c677t punktmutasjon i methylenetetrahydrofolat reduktase genet ved fluorescens resonans energioverføring og sonde smelte kurver. Anal. Biochem. 255:101–107.Crossref, Medline, CAS, Google Scholar
- 14. Wittwer, C. T., M. G. Herrmann, A. A. Moss, Og R. P. Rasmussen. 1997. Continuous fluorescence monitoring of rapid cycle DNA amplification. BioTechniques 22:130–138.Link, CAS, Google Scholar