화학 학습자
좌표 공유 결합이란 무엇입니까?
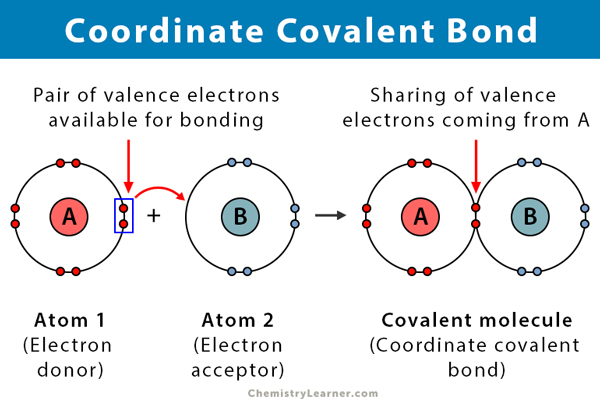
두 원자가 전자를 공유 할 때 공유 결합이 형성된다. 좌표 공유결합으로 알려진 여격 공유결합,은 종류의 공유결합에서는 공유된 한 쌍의 전자에서 오는 하나의 원자를 함유하고 있습니다. 원자는 두 핵이 모두 전자쌍을 끌어 들이기 때문에 함께 유지됩니다. 일단 공유 결합이 형성되면,전자의 기원을 구별하는 것은 불가능하다. 이러한 종류의 결합은 전형적으로 리간드에 대한 금속 이온의 결합에서 관찰된다. 그러나 비금속도이 결합에 참여할 수 있습니다. 루이스 산과 염기 사이의 반응은 좌표 공유 결합이다.
복합 이온은 금속 이온과 리간드라고 불리는 화합물의 두 가지로 만들어집니다. 리간드는 금속 이온과 결합 할 수있는 고독한 전자쌍을 포함하는 중성 분자 또는 이온입니다. 일반적인 리간드는 암모니아(NH3),물(H2O)및 할라이드 이온(Cl–,Br–)입니다. 리간드는 금속 이온과 전자쌍을 공유하고 있기 때문에 루이스 염기로 간주됩니다. 금속 이온은 항상 양수이므로 고독한 전자 쌍에 상당히 매력적입니다.
사실과 속성의 협조 공유결합
좌표 공유결합 유사한 점이 많다고 하는 공유결합. 다음은 그 속성 중 일부입니다:
- 사은 전자 기증자 및 전자락자, 일반적으로 금속과 리간드
- 사이 서로 다른 원자
- 에 의해 형성되는 공유하는 전자의 기부에 의해 하나의 원자
- 강성과 방향성
- 북극
- 원자가에 따라 이수 규칙
- atom 증 전자라는 기증하고,원자 그들을 받아들이라고는 수락자를 가진.
- 화합물은 아껴서에 수용성 물
의 예 좌표는 공유결합
여기에 몇 가지 예제의 분자 협조 공유결합 존재합니다.
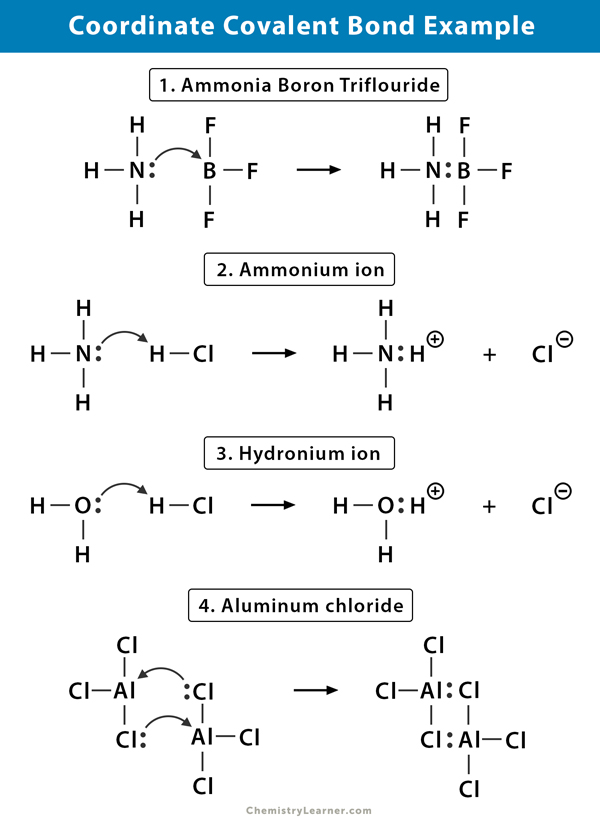
암모늄(NH4+)이온
암모늄이온이 형성되는 반응에서의 암모니아(NH3)가스와 염화수소(HCl)스입니다. NH4+에서,네 번째 수소는 수소의 핵 만이 염소로부터 질소로 전달되기 때문에 좌표 공유 결합에 의해 부착된다. 수소의 전자는 부정적인 염화물(Cl–)이온을 형성하기 위하여 염소에 뒤에 남겨집니다.
암모니아 플루오르화 붕소(NH3.BF3)
플루오르화 붕소(BF3)화합물이 없는 고귀한 가스 구조는 주변 붕소(B)atom. 붕소는 그 원자가 껍질에 3 쌍의 전자 만 가지고 있으며 궤도를 완성하기 위해 한 쌍이 필요합니다. 따라서 BF3 은 전자가 결핍되어있다. 고독한 쌍에 질소(N)의 암모니아(NH3)분자가 사용하는 것을 극복하기 위해 부족,그리고 복잡한 화합물의 양식을 통해 협조 공유결합.
염화수소(HCl)가스가 물에 용해되어 염산을 만들 때 하이드로 늄 이온(H3O+)
염화수소(HCl)가스가 물 속에 용해되면(HCl aq.),하이드로 늄 이온에 좌표 공유 결합이 형성된다. 수소(H)핵은 hydronium 을 형성하기 위해 전자의 고독한 쌍을 갖는 물(H2O)분자로 옮겨진다. 그래서,H 는 결합에 어떤 전자도 기여하지 않는다.
염화 알루미늄(Al2Cl6)
염화 알루미늄(AlCl3)에서의 결합은 본질적으로 공유 결합이다. 각 알루미늄(Al)원자는 적자로의 두 개의 전자에 드리운 shell,염소(Cl)는 고독한다. Al 은 인접한 AlCl3 그룹의 Cl 원자와 좌표 공유 결합을 형성합니다. 으로 각각 두 개의 알 원자이,알루미늄 염화물은 공유결합으로 dimer 가진 분자식 Al2Cl6.
일산화탄소(CO)
탄소(C)에는 네 개의 전자에서는 원자의 껍질,산소(O)고 있습니다. 탄소와 산소 모두 두 전자를 공유합니다. 옥텟 규칙이 산소에 만족하는 동안,탄소에 2 개의 전자의 적자가 여전히 존재한다. 그래서 산소를 공유하고 두 개의 전자와 탄소식 좌표계 공유결합,이외에 두 가지 일반(double)를 공유할 수 있습니다.