일반적인 이온 효과
과>>>>일반적인 이온 효과
이 문서 우리는 연구는 일반적인 이온 효과 및 그 응용 프로그램.
는 현상의 정도를 분리의 어떤 약이 전해질을 억제를 소량 첨가함으로써의 강한 전해질을 포함하는 일반적인 이온이라고 하는 일반적인 이온 효과가 있다.
를 들어–1:(분리의 WeakAcid)
이온화의 약세 전해질로 아세트산(CH3COOH)를 표시하지 않을 추가하여 강력한 전해질 나트륨 아세테이트(CH3COONa)을 포함하는 일반적인 아세테이트 이온(CH3COO–)
설명:
정,전해액세트산(CH3COOH)istreated 와 물. 그것은 dissociates 과 평형 existsas 다음과 같이
CH3COOH(aq)⇌CH3COO–(aq)+H+(ed)
을 적용하여 대량 작업의 법칙,
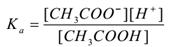
어디로’카이’분리수산입니다.
경우 작은 금액의 전해질과 같은 나트륨 아세테이트(CH3COONa)추가 수용액의 CH3COOH,그것은 해리고 균형 있으로.
CH3COONa(aq)→CH3COO–(aq)+Na+(ed)
여기에 CH3COO–이온은 일반적인 따라서 그들의 농도가 증가합니다. Le-Chatelier 의 원리에 따르면 평형은 왼쪽으로 이동합니다. Ka 의 값을 일정하게 유지하기 위해 CH3COOH 분자의 농도가 증가합니다. 이러한 방식으로 CH3COOH 의 이온화는 CH3COONa 를 첨가함으로써 억제된다. 따라서 용액의 pH 가 증가합니다.
를 들어–2:(분리의 WeakBase):
이온화의 약세 전해질 수산화암모늄(NH4OH)를 표시하지 않을 추가하여 강력한 전해질 염화 염화물(NH4Cl)containingcommon 암모늄이온(NH4+)
설명:
가 전해질 수산화암모늄(NH4OH)처리와 물. 그것은 dissociates 과 평형 existsas 다음과 같이
NH4OH(aq)⇌NH4+(aq)+OH–(ed)
을 적용하여 대량 작업의 법칙,
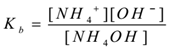
는’Kb’is 분리정의 기초입니다.
경우 작은 금액의 전해질과 같은 염화 염화물(NH4Cl)추가 수용액의 NH4OH,그것은 해리고 균형 있으로.
NH4Cl(aq)→NH4+(aq)+Cl–(ed)
여기에 NH4+이온은 일반적인 따라서 그들의 농도가 증가합니다. Le-Chatelier 의 원리에 따르면 평형은 왼쪽으로 이동합니다. Kb 의 값을 일정하게 유지하기 위해 NH4OH 분자의 농도가 증가합니다. 이러한 방식으로 NH4OH 의 이온화는 NH4Cl 을 첨가함으로써 억제된다. 따라서 용액의 pH 가 감소합니다.
일반적인 이온 효과의 응용:
정제의 일반적인 소금
원리:
의 추가 일반적인 이온을 포화 용액의 소금 원인 강의 소금이다. 이온 생성물이 용해도 생성물을 초과하면 침전이 일어난다.
Processand 설명:
포화 솔루션의 일반적인 소금,무료 fromsuspended 불순물을 촬영 하고 HCl 가스를 통해 전달됩니다. 에 saturatedsolution 의 불순 NaCI,평형 존재하는 다음과 같이
NaCl(aq)→Na+(aq)+Cl–(ed)
경우에는 순수한 HCI 가스가 전달을 통한 이 솔루션 beingstrong 전해질,그것은 dissociates 거의 완전히 균형이 존재,
HCl(aq)→H+(aq)+Cl–(aq)
이제 Cl–일반적인 이온입니다. Ci–이온(공통 이온)의 농도가 증가합니다. 에 따르면-Chatelier 의 원리 평형은 왼쪽으로 이동합니다. NaCI 의 해리는 억제되고 순수한 NaCI 는 solidsalt 로 침전된다. 따라서 순수한 NaCI 는 불순한 NaCI 의 불포화 용액에 HCI 가스를 통과시킴으로써 침전 될 수있다.
소금의 비누:
원리:
의 추가 일반적인 이온을 포화 용액의 소금 원인 강의 소금이다. 이온 생성물이 용해도 생성물을 초과하면 침전이 일어난다.
Processand 설명:
비누는 더 높은 지방산(RCOONa)의 나트륨 염입니다. 그것은 naoh 와 오일의 가수 분해에 의해 준비됩니다. 에 saturatedsoap 솔루션이 존재한 평형
ROONa(aq)→RCOO–(aq)+Na+(ed)
경우 작은 금액의 NaCl 추가되는 포화된 솔루션 비누,그것은 해리로.
NaCl(aq)→Na+(aq)+Cl–(ed)
농도의 Na+이온(일반적인 이온)를 증가합니다. 일반적인 이온 효과로 인해 비누의 해리가 감소하고 비누가 침전 된 다음 비누 용액에서 쉽게 제거 할 수 있습니다. NaCI 와 같은 소금을 첨가하여 비누 용액에서 고체 비누를 얻는이 과정을 비누에서 염장이라고합니다.