共通イオン効果
科学>>>>共通イオン効果
この記事では、一般的なイオン効果とその応用について検討します。
共通イオンを含む少量の強い電解質を添加することによって、弱い電解質の解離の程度が抑制される現象を共通イオン効果と
例–1:(弱酸の解離)
弱電解質酢酸(CH3COOH)のイオン化は、一般的な酢酸イオン(CH3COO–)を含む強電解質酢酸ナトリウム(Ch3Coona)を添加することによって抑制される
説明:
電解質酢酸(CH3COOH)が水で処理されるとする。 それは解離し、平衡が存在する次のように、
CH3COOH(aq)≤CH3COO–(aq)+H+(aq)
質量作用の法則を適用することにより、
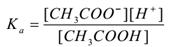
少量の酢酸ナトリウム(Ch3Coona)のような強い電解質をCH3COOHの水溶液に添加すると、解離して平衡が存在し、
Ch3Coona(aq)→CH3COO–(aq)+Na+(aq)
ここでCH3COO–イオンは一般的であるため、その濃度が増加する。 Le-Chatelierの原理によれば、平衡は左に向かってシフトする。 Kaの値を一定に保つために、CH3COOH分子の濃度を増加させる。 このようにCH3COOHのイオン化はCh3Coonaを加えることによって抑制されます。 したがって、溶液のpHは増加する。
例–2:(弱塩基の解離):
弱電解質水酸化アンモニウム(NH4OH)のイオン化は、一般的なアンモニウムイオン(NH4+)を含む強電解質塩化アンモニウム(Nh4Cl)を添加することによって抑制される
説明:
電解質水酸化アンモニウム(NH4OH)を水で処理すると仮定する。 それは解離し、平衡が存在する次のように、
NH4OH(aq)≤NH4+(aq)+OH–(aq)
質量作用の法則を適用することにより、
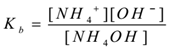
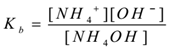
![]()
![]()
![]() div>
div>
ここで、’kb’は塩基の解離定数です。
塩化アンモニウム(Nh4Cl)のような少量の強い電解質をNH4OHの水溶液に添加すると、解離し、平衡が存在するので、
Nh4Cl(aq)→NH4+(aq)+Cl–(aq)
ここでNH4+イオンは一般的であるため、その濃度が増加する。 Le-Chatelierの原理によれば、平衡は左に向かってシフトする。 Kbの値を一定に保つために、NH4OH分子の濃度を増加させる。 このようにNH4OHのイオン化はNh4Clを加えることによって抑制されます。 したがって、溶液のpHは低下する。
一般的なイオン効果の応用:一般的な塩の精製:
原理:
塩の飽和溶液に一般的なイオンを添加すると、塩の沈殿が発生します。 イオン生成物が溶解性生成物を超えると、沈殿が起こる。
プロセスと説明:
懸濁した不純物を含まない一般的な塩の飽和溶液を採取し、HClガスを通過させる。 不純なNaCIの飽和溶液では、平衡は次のように存在し、
NaCl(aq)→Na+(aq)+Cl–(aq)
純粋なHCIガスがこの溶液を通過すると、強い電解質はほぼ完全に解離し、平衡が存在する、
HCl(aq)→H+(aq)+Cl–(aq)
Cl–は一般的なイオンである。 CIイオン(共通イオン)のconcentrationofは高められます。 ル-シャトリエの原理によれば、平衡は左に向かってシフトする。 NaCIの解離は抑制され、純粋なNaCIは固体塩として沈殿する。 従って、純粋なNaciは、不純なNaciの飽和溶液中にH C iガスを通過させることによって沈殿させることができる。
石鹸の塩漬け:
原則:
塩の飽和溶液に一般的なイオンを添加すると、塩の沈殿が発生します。 イオン生成物が溶解性生成物を超えると、沈殿が起こる。
プロセスと説明:
石鹸は、高級脂肪酸(RCOONa)のナトリウム塩です。 これは、naohによる油の加水分解によって調製される。 飽和soap溶液には平衡が存在し、
ROONa(aq)→RCOO–(aq)+Na+(aq)
飽和石鹸溶液に少量のNaClを添加すると、Na+イオン(共通イオン)の濃度が増加するにつれて解離する。 共通のイオン効果が原因で、石鹸の分離は減り、石鹸は沈殿して得、次に石鹸の解決から容易に取除くことができます。 NaCIのような塩を加えることによって石鹸の解決から固体石鹸を、得るこのプロセスは石鹸からの塩析と呼ばれます。