Studente di chimica
Che cos’è un legame covalente coordinato?
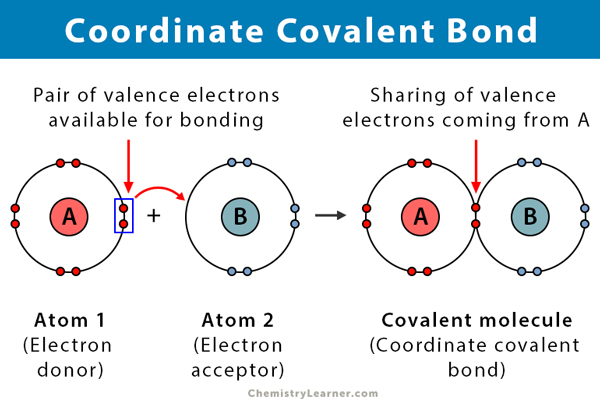
Un legame covalente si forma quando due atomi condividono elettroni. Un legame covalente coordinato, noto anche come legame covalente dativo, è un tipo di legame covalente in cui la coppia condivisa di elettroni proviene da uno degli atomi. Gli atomi sono tenuti insieme perché entrambi i nuclei attraggono la coppia di elettroni. Una volta formato il legame covalente, è impossibile distinguere l’origine degli elettroni. Questo tipo di legame è tipicamente osservato nel legame di ioni metallici ai ligandi. Tuttavia, i non metalli possono anche partecipare a questo legame. La reazione tra acido di Lewis e base è un legame covalente coordinato .
Uno ion complesso è costituito da due cose, uno ion metallico e composti chiamati ligandi. I ligandi sono molecole neutre o ioni contenenti coppie di elettroni solitari che possono legarsi con lo ion metallico. I leganti comuni sono ammoniaca (NH3), acqua (H2O) e ioni alogenuri (Cl–, Br–). I ligandi sono considerati basi di Lewis perché condividono le loro coppie di elettroni con lo ion metallico. Gli ioni metallici sono sempre positivi, quindi sono abbastanza attraenti per coppie di elettroni solitari.
i Fatti e le Proprietà di Legame coordinativo
Il legame coordinativo ha molte somiglianze con quella del legame covalente. Ecco alcune delle sue proprietà:
- avviene tra un elettrone donatore e accettore di elettroni, in genere tra un metallo e un ligando
- avviene tra dissimili atomi
- Formato dalla condivisione di elettroni donati da uno degli atomi
- Rigida e direzionale
- Polar
- Atomi di seguire la regola dell’ottetto
- L’atomo di donare elettroni è chiamato un donatore, e l’atomo di accettare di essi è un accettore.
- I composti sono scarsamente solubili in acqua
Esempi di legame covalente coordinato
Ecco alcuni esempi di molecole in cui esiste un legame covalente coordinato .
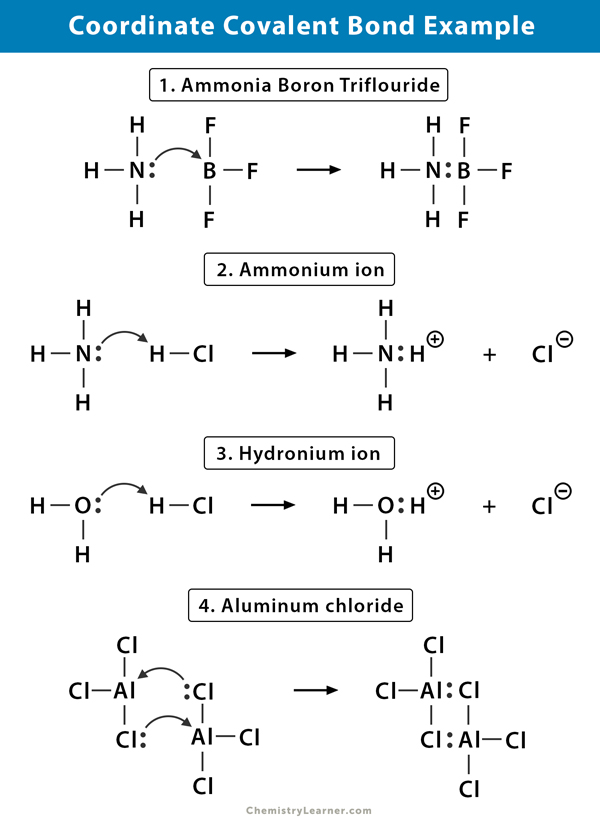
Ammonium ammonio (NH4+)
Lo ammonium ammonio è formato dalla reazione del gas di ammoniaca (NH3) con gas di cloruro di idrogeno (HCl). In NH4+, il quarto idrogeno è attaccato da un legame covalente coordinato perché solo il nucleo dell’idrogeno viene trasferito dal cloro all’azoto. L’elettrone dell’idrogeno viene lasciato sul cloro per formare uno chloride cloruro negativo (Cl -).
Trifluoruro di boro di ammoniaca (NH3. BF3)
Il trifluoruro di boro (BF3) è un composto che non ha una struttura di gas nobile attorno all’atomo di boro (B). Il boro ha solo tre coppie di elettroni nel suo guscio di valance e richiede una coppia per completare l’orbitale. Quindi, BF3 è carente di elettroni. La coppia solitaria sull’azoto (N) della molecola di ammoniaca (NH3) viene utilizzata per superare tale carenza e un composto complesso si forma attraverso un legame covalente coordinato.
ion idronio (H3O+)
Quando il gas di cloruro di idrogeno (HCl) si dissolve in acqua per produrre acido cloridrico (HCl aq.), un legame covalente coordinato si forma nello hyd idronio. Il nucleo di idrogeno (H) viene trasferito alla molecola di acqua (H2O), che ha una coppia solitaria di elettroni per formare idronio. Quindi, H non contribuisce alcun elettrone al legame.
Cloruro di alluminio (Al2Cl6)
Il legame nel cloruro di alluminio (AlCl3) è essenzialmente covalente. Ogni atomo di alluminio (Al) ha un deficit di due elettroni nel suo guscio di valance e il cloro (Cl) ha una coppia solitaria. Al forma un legame covalente coordinato con l’atomo Cl su un gruppo AlCl3 adiacente. Poiché ciascuno dei due atomi di Al fa questo, allora il cloruro di alluminio è una molecola di dimero covalente con la formula Al2Cl6.
Monossido di carbonio (CO)
Il carbonio (C) ha quattro elettroni nel suo guscio di valenza e l’ossigeno (O) ne ha sei. Sia il carbonio che l’ossigeno condividono i loro due elettroni. Mentre la regola dell’ottetto è soddisfatta dell’ossigeno, c’è ancora un deficit di due elettroni sul carbonio. Quindi, l’ossigeno condivide i suoi due elettroni con il carbonio per formare un legame covalente coordinato, oltre ai due legami covalenti regolari (doppi).