Comune Effetto dello Ione
Scienza > Chimica > Chimica > Equilibri Ionici > Comune Effetto dello Ione
In questo articolo, si è scelto di studiare l’effetto dello ione a comune e delle sue applicazioni.
Il fenomeno in cui il grado di dissociazione di qualsiasi elettrolita debole viene soppresso aggiungendo una piccola quantità di elettrolita forte contenente uno ion comune è chiamato effetto ionico comune.
Esempio-1: (Dissociazione di un acido debole)
La ionizzazione dell’acido acetico elettrolitico debole (CH3COOH)viene soppressa aggiungendo acetato di sodio elettrolitico forte (CH3COONa) contenente acetate acetato comune (CH3COO–)
Spiegazione:
Supponiamo che un acido acetico elettrolitico (CH3COOH) sia trattato con acqua. Si dissocia e un equilibrio existsas segue,
CH3COOH(aq) ⇌CH3COO–(aq) + H+(aq)
applicando la legge di azione di massa,
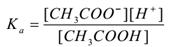
Dove ‘Ka’ è la costante di dissociazione dell’acido.
Se una piccola quantità di un elettrolita forte come acetato di sodio (CH3COONa) viene aggiunto alla soluzione acquosa di CH3COOH, viene dissociato e l’equilibrio che esiste, come
CH3COONa(aq) → CH3COO–(aq) + Na+(aq)
CH3COO– ioni sono comuni, quindi, la loro concentrazione aumenta. Secondo il principio di Le-Chatelier, l’equilibrio si sposta verso sinistra. Per mantenere il valore di Ka costante, la concentrazione di molecole di CH3COOH è aumentata. In questo modo la ionizzazione di CH3COOH viene soppressa aggiungendo CH3COONa. Quindi il pH della soluzione aumenta.
Esempio-2: (Dissociazione di una base debole):
La ionizzazione dell’idrossido di ammonio elettrolitico debole (NH4OH) viene soppressa aggiungendo cloruro di ammonio elettrolitico forte (NH4Cl) contenente ion ammonio comune (NH4+)
Spiegazione:
Supponiamo che un idrossido di ammonio elettrolitico (NH4OH) venga trattato con acqua. Si dissocia e un equilibrio existsas segue,
NH4OH(aq) ⇌ NH4+(aq) + OH–(aq)
applicando la legge di azione di massa,
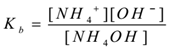
per il Dove Kb è la costante di dissociazione della base.
Se una piccola quantità di un elettrolita forte come il cloruro di ammonio (NH4Cl) viene aggiunta alla soluzione acquosa di NH4OH, si dissocia e l’equilibrio esiste, poiché
NH4Cl(aq) → NH4+(aq) + Cl–(aq)
Qui gli ioni NH4+ sono comuni, quindi la loro concentrazione aumenta. Secondo il principio di Le-Chatelier, l’equilibrio si sposta verso sinistra. Per mantenere costante il valore di Kb, la concentrazione di molecole NH4OH viene aumentata. In questo modo la ionizzazione di NH4OH viene soppressa aggiungendo NH4Cl. Quindi il pH della soluzione diminuisce.
Applicazioni di effetto ionico comune:
Purificazione del sale comune:
Principio:
L’aggiunta di ion comune a una soluzione satura di sale provoca la precipitazione del sale. Quando il prodotto ionico supera il prodotto di solubilità, avviene la precipitazione.
Processand Spiegazione:
Viene prelevata una soluzione satura di sale comune, priva di impurità sospese e il gas HCl viene passato attraverso di esso. In una soluzione saturata di NaCI impuro, l’equilibrio esiste come segue,
NaCl(aq) → Na+(aq) + Cl–(aq)
Se il gas HCI puro viene passato attraverso questa soluzione, essendoun elettrolita forte, si dissocia quasi completamente e l’equilibrio esiste,
HCl(aq) → H+(aq) + Cl–(aq)
Ora Cl– è uno ion comune. La concentrazione di ioni CI (ioni comuni) è aumentata. Secondo il principio di toLe-Chatelier l’equilibrio si sposta verso sinistra. La dissociazione di NaCI viene soppressa e il NaCI puro viene precipitato come solidsalt. Così il NaCI puro può essere precipitato facendo passare il gas di HCI nella soluzione thesaturated di NaCI impuro.
Salatura del sapone:
Principio:
L’aggiunta di ion comune a una soluzione satura di sale provoca la precipitazione del sale. Quando il prodotto ionico supera il prodotto di solubilità, avviene la precipitazione.
Processoe spiegazione:
Il sapone è sale sodico di acidi grassi superiori (RCOONa). È preparato per idrolisi di oli con NaOH. Nella soluzione di sapone saturato esiste un equilibrio,
ROONa(aq) → RCOO–(aq) + Na+(aq)
Se una piccola quantità di NaCl viene aggiunta alla soluzione di sapone saturo, si dissocia come
NaCl(aq) → Na+(aq) + Cl–(aq)
La concentrazione di ioni Na+ (ion comune) aumenta. A causa dell’effetto ionico comune, la dissociazione del sapone viene ridotta e il sapone viene precipitato e quindi può essere facilmente rimosso dalla soluzione di sapone. Questo processo di ottenere sapone solido dalla soluzione di sapone, aggiungendo sale come NaCI è chiamato salatura dal sapone.