Fret-TaqMan szondák tervezése multiplex valós idejű PCR-hez belső pozitív kontroll segítségével
Bevezetés
valós idejű PCR lehetővé teszi a fluorofór fluoreszcencia folyamatos ellenőrzését a PCR termékek előállítása során zárt csőformátumban. Jelenleg a rendelkezésre álló módszerek akár jelzett szondákat, akár DNS interkaláló festéket használnak a PCR termék erősítésének ellenőrzésére. A TaqMan-szonda egy egyszálú oligonukleotid, amely fluorofórt tartalmaz, a quencher pedig 10-30 bázist helyez el egymástól. A TaqMan szondát az amplifikáció során hidrolizálják a Taq polimeráz 5′ -3 ‘ kettős szál-specifikus exonukleáz aktivitása miatt, amely elválasztja a fluoroforot a kioltótól, ami fluoreszcencia növekedést eredményez. A valós idejű PCR műszerek fluoreszcens detektorokkal és szoftverekkel vannak felszerelve, amelyek képesek megbecsülni a ciklusküszöböt (Ct), a ciklust, amelynél a fluoreszcencia nagyobb, mint a háttér-fluoreszcencia, a pozitív reakciók szempontjából. A technika azonban nem képes megkülönböztetni a valódi negatív eredményt a hamis negatívtól, ha a PCR-t amplifikációs inhibitorok befolyásolják. Nukleinsav-extrakciót követően arról számoltak be, hogy az inhibitorok továbbra is jelen lehetnek klinikai mintákból (például hemoglobinból), környezeti mintákból (például huminsavból és fulvinsavból), valamint nukleinsav-extrakció során alkalmazott vegyi anyagokból (például etanolból, mosószerekből vagy kaotróp szerekből). A diagnosztikai vizsgálatok megbízhatóságát növeli egy olyan belső kontroll nukleinsav beépítése, amely jelezheti a PCR-gátlók jelenlétét és hatását (1,2). A belső pozitív kontrollt (IPC) egyidejűleg felerősítik egy célszekvencia jelenlétében egy címkével ellátott fluorofor segítségével, amely más hullámhosszon bocsát ki fényt, mint a célszekvencia-vizsgálathoz használt fluorofor, a két fluorofor, amelyeket a valós idejű PCR műszer különböző csatornákban érzékel. A PCR általánosan használt belső vezérlője egy plazmid, amely a vizsgálati célhoz hasonló szekvenciát tartalmaz, kivéve a szonda régióját. Az egyedi vizsgálati célhoz korlátozott számú IPC-molekulát adunk, és a cél nukleinsavval együtt erősítjük; így a pozitív IPC jel bizonyíték arra, hogy az amplifikációs reakció eléggé folytatódott ahhoz, hogy pozitív jelet generáljon nagyon kis mennyiségű cél nukleinsavból. Ez a tulajdonság fontos az IPC és a cél nukleinsav egyenértékű amplifikációjának biztosításához (3-9). Azonban néhány eszköz—például a LightCycler 1.2 és a LightCycler 2 (Roche Applied Science, Indianapolis, IN, USA), A Ruggedized Advanced Pathogen Identification Device (R. A. P. I. D.) műszer—Idaho Technology, Salt Lake City, UT, USA) és kézi valós idejű PCR műszerek – csak egy fényforrással és kapcsolódó emissziós csatornával vannak felszerelve. Az ilyen típusú műszerek multiplexeléséhez több címkével ellátott oligonukleotidok, valamint a fluoreszcencia rezonancia energiaátvitel (FRET) koncepció használata szükséges. A FRET szondák azonban kihívást jelenthetnek a tervezés szempontjából, és hiányozhatnak a robusztusság a hiperváltozható régiókban, valamint ha nem optimális erősítési feltételek vannak jelen. A FRET szondák használata két régió azonosítását igényli két szonda számára. A FRET szondarendszer a két egycímkézett szonda oligonukleotidjainak szomszédos hibridizációjára támaszkodik oly módon, hogy az akceptor festék fluoreszcenciáját a második szondához csatlakoztatott fluorofor gerjesztésén keresztül detektálják. A FRET szonda egyik fő hátránya, hogy egy nagyobb szekvenciaterületre van szükség, amely két szomszédos szonda elhelyezéséhez szükséges, 2-5 nukleotid réssel. Lehetőség van más címkerendszerekkel, például a MegaStokes dye (DYXL; Dyomics, Jena, Németország) és a Pulsar 650 (Biosearch Technologies, Inc., Novato, CA, USA), de ezek a címkézési rendszerek spektrális információkat igényelnek a csatorna áthallásának kompenzálására, és nem állnak széles körben rendelkezésre. A tanulmányban kifejlesztett FRET-TaqMan szonda azonban nem igényel színkompenzáló szoftvert, és széles körben elérhető fluorofórokat (FAM, Cy5.5) használ. A jelen jelentés egy hármas jelzésű szonda tervezésére összpontosít, amely lehetővé teszi a multiplexelést egyetlen kék fénykibocsátó dióda (LED) gerjesztési forrással (470 nm) és a kapcsolódó három megfelelő érzékelési csatornával (például 530 nm, 640 nm és 705 nm) felszerelt műszer esetében.
Anyagok, módszerek
Szonda tervezési elv
Minden kísérleteket végeztek a Idaho Technológia R. A. P. I. D. rendszer, egy 32-minta hordozható real-time PCR berendezés rendelkezik egy kék LED a gerjesztés (470 nm), valamint a kapcsolódó három fluoreszcencia észlelési csatornák az intézkedés a fluoreszcencia 530, 640, valamint 705 nm-es mono -, illetve kettős-szín vizsgálatok. A JVAF és a JVAR (10) primereket és az 5′-FAM/BHQ-1 szondát a CDC biotechnológiai Maglétesítményében (Atlanta, GA, USA) szintetizálták, az 5 ‘FAM-Cy5.5/3′ BHQ-3 szondát pedig az Idaho Technology-ban szintetizálták. A duplex TaqMan PCR engedélyezéséhez az egyik szondát 5’-FAM/BHQ-1 (520 nm fluoreszcencia hullámhossz), a másikat pedig 5 ‘FAM-Cy5.5/3’ BHQ-3 (705 nm fluoreszcencia hullámhossz) címkével látták el. Az oldatban az 5 ‘FAM-Cy5.5/3’ BHQ-3 jelzésű szondát a hibridizáció során egy szekvenciára leállítják, majd a szonda enzimatikus primer kiterjesztéssel történő hasítását követően a kioltó megszűnik. Ez azt eredményezi, hogy a FAM gerjesztése az R. A. P. I. D. műszer fényforrásával történik. A gerjesztési energia átkerül az akceptor fluorofor, Cy5.( 5) a kibocsátott fluoreszcenciát egy második fluoreszcens csatornán (az R. A. P. I. D. műszer F3 fluoreszcens csatornája) mérik. A Cy5. 5 fluoreszcencia kibocsátása a Fret és a TaqMan szondatechnikák kombinációjának eredménye, így ezeket a hármas címkével ellátott szondákat “FRET-TaqMan” szondáknak lehet nevezni.
primerek, szondák és plazmid
a Fret-TaqMan tervezés multiplexelő képességeinek bemutatásához egy nemzetségre jellemző Cryptosporidium valós idejű PCR vizsgálatot használtunk a 18S rRNA gén (10) 159-bp részének erősítésére. Az elülső alapozó (JVAF) 5′-ATGACGGGTAACGGGGAAT-3′, a fordított alapozó (JVAR) 5′-CCAATTACAAAAAC-CAAAAAGTCC-3′, a TaqMan szonda (JVAP) pedig 5′-FAM-CGCGCCTGCTGCT-GCTTCCTTAGATG-BHQ1–3 ‘ volt, ami a 100-118, 258-236 nukleotidoknak felel meg, és a GenBank 184-161. AY458612. A Cryptosporidium IPC felépítésére szolgáló primerek ugyanazokat a primer szekvenciákat tartalmazták, amelyeket a Cryptosporidium spp. erősítésére jelentettek., kivéve a cél DNS szonda-kötő régióját, amelyet az 5′-ttgtgctcgtagtcgcctctctctctctctct-3′ (JPIPC) mesterséges szekvenciával helyettesítettek. Ennek a szonda szekvenciának 69°C-os lágyítási hőmérséklete volt, és úgy tervezték, hogy nincs másodlagos szerkezete. A belső szonda elméleti specifikusságát a szonda és az alapozó szekvenciák robbanásszerű (11) kutatásával állapították meg, amelyben semmilyen Kriptosporidium szekvenciával nem találtak pontos egyezést. Az IPC-fragmentumot az integrált DNS-technológiák (Coralville, IA, USA) szintetizálták és plazmidba klónozták. A plazmid DNS ismert koncentrációja (100 kópia/reakció) az összes reakció mesterkeverékébe került, kivéve a negatív kontrollt. Az IPC-re jellemző hármas címkével ellátott szondát (JPIPC) az Idaho technológia szintetizálta, amint azt az 1.ábra mutatja. A FAM/Cy5.5/BHQ3 oligo-nukleotid szondát a 3’ végén szintetizálták, nem fluoreszkáló Fekete lyukú Quencher (BHQ-3) vezérelt pórusüveggel (CPG). Az 5 ‘végét ezután Konjugáltuk egy Cy5. 5 phosporamidittal, majd egy terminális 5’ fluoreszcein (6-FAM) phosporamidittal.
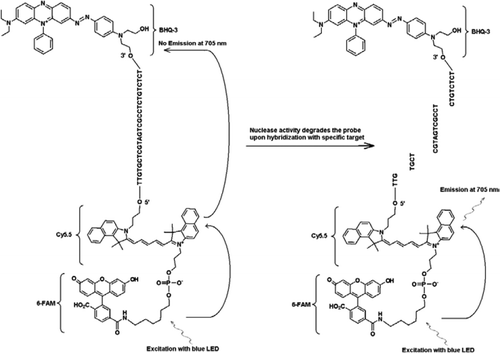
a FRET-TaqMan szonda három címkét tartalmaz: a 3′ kar végén egy fekete lyukú kioltó rész, a fluorofór emitter (Cy5.5), az 5′ kar végén pedig egy betakarító fluorofór (FAM) csatlakozik egymáshoz. A FAM hatékonyan elnyeli a kék LED-ből származó energiát fényforrásként. Célok hiányában a szonda sötét, mert a FAM által elnyelt energia átkerül a Cy5. 5-re,viszont a Cy5-ből felszabaduló energia.5 átkerül a kioltó, és elvész, mint a hőenergia. Célpontok jelenlétében a TaqMan-szondát a Taq polimeráz aktivitása hasítja le, és a quencher felszabadul, és a FAM által elnyelt energiát 705 nm-es fluoreszcencia kibocsátására szolgáló mechanizmuson keresztül átviszik a Cy5.5-re.
valós idejű PCR vizsgálat
áramlási citometria rendezve Cryptosporidium parvum oocysts (200 oocysts / cső) nyert a University of Wisconsin State Laboratory of Hygiene (Madison, WI, USA). DNS C-ből. a parvum oocisztákat a Hill et al által leírt protokoll segítségével extrahálták. (12) és 80 µL Tris EDTA (TE, pH 8.0) pufferben felfüggesztve. Reakciónként két mikro-liter DNS-t adtak hozzá, amely 5 oocisztának felel meg (ami a cél DNS 100 példányának felel meg). Az amplifikációs reakció keverék Quantifast Probe PCR + ROX kit reakció keverékből (Cat. no. 204354; Qiagen) no ROX hozzáadott, JVAF, jvar alapozók (0,4 µM mindegyik), JVAP szonda (0,2 µM), jpipc szonda (0,2 µM), és 100 példányban az IPC. A kivont DNS-mintából egy aliquot (2 µL) került a 18 µL-es reakciókeveréket tartalmazó reakciókapillárisba (Roche Diagnostics, Indianapolis, IN, USA). A C. parvum genomikus DNS-pozitív kontroll (2. ábra, 1. ábra), az IPC plazmid (2. ábra, 2. ábra), A C. parvum pozitív kontroll és az IPC keveréke (2. ábra, 3. ábra), valamint egy nukleázmentes vízből (Cat. Nem. AM9932; Ambion, Foster City, CA, USA) A DNS helyett (2.ábra, 4. ábra) minden kísérletben szerepeltek. A protokoll ∼30 percet vett igénybe a következő PCR feltételek teljesítéséhez: hot-start lépés denaturáció: 95°C, 3 perc, majd 45 ciklus 95°C-os denaturáló 5 s, 60°C-on történő hőkezelés 30 s egyetlen fluoreszcencia megszerzése (a hőmérséklet földi mértéke 20°C/s). Az F1 (530 nm) és az F3 (705 nm) csatornában a Fam esetében pozitív eredményt regisztráltak. Az amplifikációs reakciókat három példányban végezték el. Az amplikonokat (159 bp) agaróz gélelektroforézissel és Glow-Green nukleinsavfestéssel (eEnzyme, Gaithersburg, MD, USA) ábrázolták a PCR termék specifikusságának megerősítése érdekében.
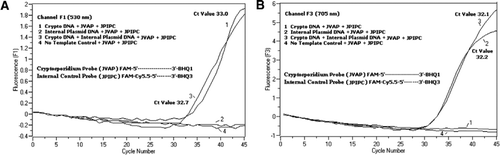
egy FAM/BHQ1 és egy Fam/Cy5.5/BHQ3 ekvimoláris keveréke került hozzáadásra minden PCR reakciókeverékhez. A) A csatorna F1 monitorjai növelik a FAM fluoreszcenciát a C. parvum jelenlétére. Plot 1 (csatorna F1 elsősorban gyűjt FAM jel), amely csak C. parvum DNS kiderült Cryptosporidium-specifikus FAM jel a PCR. A 2. ábra csak plazmid DNS-t tartalmazott, és a FAM/Cy5.5/BHQ3 szonda FAM jelét nem. Telek 3 tartalmazott mindkét C. parvum és plazmid DNS, de csak C. parvum–specifikus FAM jelet termelt. A 4. parcella negatív minta volt, amely csak nukleázmentes vizet tartalmazott bármely sablon DNS helyett; a szondákból nem figyeltek meg fluoreszcenciát. B) Az F3 csatorna figyeli a Cy5. 5 növekedését a belső kontroll plazmid DNS jelenlétében. Az 1. ábra csak C. parvum DNS-t tartalmazott, és a FAM/ BHQ1 szonda nem mutatott fluoreszcens jelet. 2. ábra (az F3 csatorna elsősorban Cy5. 5 jelet gyűjt), amely csak plazmid DNS-t tartalmaz, belső plazmidvezérlést (IPC) mutatott-specifikus Cy5.5 jel a PCR-ben. Telek 3 tartalmazott mindkét C. parvum és plazmid DNS, de csak IPC-specifikus Cy5.5 jelet termelt. A 4. parcella negatív minta volt, amely csak nuclease-mentes vizet tartalmazott bármely sablon DNS helyett; a szondákból nem figyeltek meg fluoreszcenciát.
eredmények és viták
valós idejű PCR fluoreszcencia jelek, amelyek a C. parvum genomikus DNS amplifikációját tükrözik, az F1 csatornán (2a ábra) észlelték a TaqMan szonda FAM címkézése miatt. Az IPC erősítését tükröző fluoreszcencia jelet az F3 csatornában (2b ábra) észlelték a FAM/Cy5 miatt.5 az IPC TaqMan szonda címkézése. Ez a szonda az F3 csatornán (Cy5.5) A Cy5.5 növekedését eredményezte, de az F1 csatornában (FAM) a FAM/Cy5.5-től elválasztott BHQ3-tól a nukleázaktivitás miatt nem nőtt a FAM (Fam), mivel az energiát a FAM-ről a Cy5.5-re továbbították. Hasonlóképpen, a duplex reakcióban a C. parvum genomikus DNS-amplifikációt detektáltuk az F1 csatornában, míg az IPC amplifikációt egyidejűleg detektáltuk az F3 csatornában. A FAM gerjesztése 495 nm, kibocsátása 520 nm. A Cy5.5 690 nm-es gerjesztéssel és 705 nm-es emisszióval rendelkezik. A hármas jelöléssel ellátott IPC-szondán a Cy5.5 és a FAM közötti ilyen közelség mellett a Cy5.5 fluorofor fluoreszcenciát bocsát ki a FAM fluoroforból származó energia teljes átvitelének köszönhetően, ami az F1 csatornában nem eredményez fluoreszcens Fam-kibocsátást (2a.ábra). A negatív kontrollreakciók nem mutatták a fluoreszcencia növekedését a FAM vagy a Cy5.5 miatt. Ezek az eredmények azt is bizonyítják, hogy egyetlen kék (470 nm) LED-forrás elegendő az F1 (530 nm) és F3 (705 nm) csatornákon keresztül történő kettős fluoreszcencia-kibocsátás monitorozásához anélkül, hogy a FAM és a Cy5.5 megfelelő monitoringcsatornáiban spektrális átfedés lenne. A FRET-TaqMan technika is tesztelték a panel a 12 DNS-kivonatok széklet példányok (8 származó példányok korábban megállapították, hogy pozitív legyen a Cryptosporidium spp. és négy olyan példány, amely a Cryptosporidium spp.esetében negatív volt.). A 18S rRNA vizsgálat mind a nyolc Cryptosporidium spp. Az IPC TaqMan vizsgálat során megállapították, hogy csak az IPC plazmid DNS-t erősíti. Az IPC-vizsgálat 32-37-es Ct-értékeket eredményezett, amelyek egyes székletminták esetében legfeljebb 5 Ct-s PCR-gátlást jeleztek (32 volt a No-gátlási reakciók várható Ct-értéke).
a jelen technika abban különbözik a hagyományosan használt FRET-től, hogy egy fluoreszcens címkével ellátott oligonukleotid szondát (FRET-TaqMan szonda) használnak két szonda helyett (FRET szondák), amelyekben az egyik szonda tartalmazza a donor fluoroforot, a másik szonda pedig az akceptor fluoroforot (13,14). A FRET-TaqMan szondát az 5 “végén két donor (FAM) és akceptor (Cy5.5) fluorofórral, a 3″ végén pedig egy BHQ-3 kioltóval, mint egy TaqMan szonda. Az egyedi szonda-kötelező régió kiválasztott megkülönböztetni a cél DNS olyan, mint a monitor két különböző fluoreszcencia mérések két különböző észlelési csatornák (530 nm-es F1-ben, majd 705 nm F3) ugyanabból a amplifikációs reakció nélkül kell, hogy tartalmazza a szín kompenzáció szoftver. A cél DNS és IPC ugyanazokkal a primer kötőhelyekkel rendelkezett, de más szondaszekvenciával. Ez biztosítja, hogy mindkét DNS-célhoz ugyanazokat az alapozókat használják, hogy minimalizálják a primer-dimer képződést vagy a primer készletek közötti kölcsönhatást. Amikor a FAM / Cy5. 5 fluorofórokat szorosan az 5 ” végére helyezzük, a rezonancia energiaátvitel a Cy5.5 fluorofor fluoreszcencia-kibocsátásának növekedésével történik. A BHQ3, a Cy5.5 nem fluoreszcens akceptor használata azonban csökkenti a potenciális háttér-fluoreszcenciát, ami magasabb jel-zaj arányt eredményez. Megállapítást nyert, hogy az IPC 100 példányának hozzáadása egy ∼100 genomikus C-t tartalmazó reakcióhoz. a parvum DNS hasonló Ct-értékeket eredményezett (Ct = 32), amikor a Cryptosporidium TaqMan-vizsgálatot singleplex assay-ként, valamint duplex assay-ként végezték el az IPC TaqMan assay-vel. Amikor egy Kriptosporidium-pozitív DNS-mintákra alkalmazták, az IPC azt jelezte, hogy egyes példányok nem tartalmaznak PCR-gátlókat (a 32-es várható Ct-értékek alapján), de más példányok legfeljebb 5 Ct-értékek gátlásával jártak.
Az újonnan kifejlesztett belső PCR pozitív kontroll bizonyult érzékeny, egyedi egyidejű kimutatására két célok ugyanaz a reakció miatt a címke a FAM/Cy5.5-BHQ3, valamint FAM/BHQ1 az adott IPC, valamint 18 rrns cél gén egy dual-szín multiplex PCR megfigyelésére az F1-ben, majd F3 fluoreszcencia-csatornák az R. A. P. I. D eszköz. Az 5 ‘FAM-Cy5.5/3’ BHQ-3 jelzésű szonda második riporterként való használata előnyös, mivel a két szonda kibocsátási maximuma jól el volt távolítva egymástól. A FRET-TaqMan háromszoros jelölt szonda design volna alkalmazások fejlesztése egy olcsó, eldobható “lab-on-a-chip” készülék optika, amely egy kék LED a gerjesztő két kibocsátási források, 530 nm-705 nm, a megfelelő optikai szűrők felismerni a CSALÁD egy csatornát, majd Cy5.5 a másik. Ehhez a kombinációhoz nem lenne szükség két nagy teljesítményű fluoreszcens forrásra és detektáló rendszerre.
a szerzők elismerik Mike Powers segítségét a DNS-Szekvenálásban és a genomikus Maglétesítményben (Utah Egyetem, Salt Lake City, UT, USA) és Rachelle Muller segítségét az Idaho Technology, Inc. – nél. az R. A. P. I. D cikler belső pozitív kontrolljának fejlesztéséről szóló vita. Ezt a kiadványt részben a járványvédelmi és Megelőzési központokon, a terrorizmusra való felkészültség és a vészhelyzeti reagálás koordinációs hivatalán keresztül rendelkezésre bocsátott források támogatták. A kereskedelmi nevek és kereskedelmi források használata csak azonosításra szolgál, és nem jelenti azt, hogy a Centers for Disease Control and Prevention vagy az Amerikai Egészségügyi és Emberi Szolgáltatások Minisztériuma jóváhagyja.
- 1. Hartman, L. J., S. R. Coyne és D. A. Norwood. 2005. Új belső pozitív kontroll kifejlesztése a Taqman alapú tesztekhez. Mol. Cell. Szondi 19:51-59.Crossref, Medline, CAS, Google Scholar
- 2. Hoorfar, J., B. Malorny, A. Abdulmawjood, N. szakács, M. Wagner és P. Fach. 2004. Gyakorlati megfontolások a diagnosztikai PCR-vizsgálatok belső erősítési vezérlőinek tervezésében. J. Clin. Mikrobiol. 42:1863–1868.Crossref, Medline, CAS, Google Scholar
- 3. Betsou, F., K. Beaumont, J. M. Sueur és J. Orfila. 2003. A Chlamydia trachomatis DNS PCR-amplifikációjára szolgáló belső kontroll DNS felépítése és értékelése vizeletmintákból. J. Clin. Mikrobiol. 41:1274–1276.Crossref, Medline, CAS, Google Scholar
- 4. Burggraf, S. és B. Olgemoller. 2004. Egyszerű technika a valós idejű erősítési vizsgálatok belső vezérléséhez. Clin. Chem. 50:819–825.Crossref, Medline, CAS, Google Scholar
- 5. Drosten, C., M. Weber, E. Seifried és W. K. Roth. 2000. Egy új PCR-vizsgálat értékelése versenyképes belső ellenőrzési szekvenciával a vérdonor szűréséhez. 40. perc: 718-724.Crossref, Medline, CAS, Google Scholar
- 6. Gruber, F., F. G. Falkner, F. Dorner és T. Hammerle. 2001. A vírus DNS-ét a duplex amplifikáció, a belső szabványosítás és a kétszínű fluoreszcencia detektálás alkalmazásával valós idejű PCR-vel kvantálják. Appl. Environ. Mikrobiol. 67:2837–2839.Crossref, Medline, CAS, Google Scholar
- 7. Rosenstraus, M., Z. Wang, S. Y. Chang, D. DeBonville és J. P. Spadoro. 1998. A rutin diagnosztikai PCR belső ellenőrzése: tervezés, tulajdonságok és a klinikai teljesítményre gyakorolt hatás. J. Clin. Mikrobiol. 36:191–197.Medline, CAS, Google Scholar
- 8. Stocher, M., V. Leb és J. Berg. 2003. Kényelmes megközelítés a többszörös belső vezérlő DNS előállításához a valós idejű PCR-vizsgálatok paneljéhez. J. Virol. Módszerek 108: 1-8.Crossref, Medline, CAS, Google Scholar
- 9. Zimmermann, K. és J. W. Mannhalter. 1996. A mennyiségi versenyképes PCR technikai szempontjai. BioTechniques 21:268-279.Link, CAS, Google Scholar
- 10. Jothikumar, N., A. J. da Silva, I. Moura, Y. Qvarnstrom és V. R. Hill. 2008. A Cryptosporidium hominis és Cryptosporidium parvum detektálása és differenciálása kettős TaqMan-vizsgálatokkal. J. Med. Mikrobiol. 57:1099–1105.Crossref, Medline, CAS, Google Scholar
- 11. Altschul, S. F., W. Gish, W. Miller, E. W. Myers és D. J. Lipman. 1990. Alapvető helyi igazítás kereső eszköz. J. Mol. Biol. 215:403–410.Crossref, Medline, CAS, Google Scholar
- 12. Hill, V. R., A. M. Kahler, N. Jothikumar, T. B. Johnson, D. Hahn és T. L. Cromeans. 2007. Az ultraszűrésen alapuló eljárás többállami értékelése a bélben oldódó mikrobák egyidejű helyreállítására 100 literes csapvízmintákban. Appl. Environ. Mikrobiol. 73:4218–4225.Crossref, Medline, CAS, Google Scholar
- 13. Bernard, P. S., M. J. Lay és C. T. Wittwer. 1998. A metilén-tetrahidrofolát-reduktáz gén c677t pontmutációjának integrált amplifikációja és kimutatása fluoreszcens rezonancia energiaátviteli és szonda olvadási görbékkel. Anális. Biochem. 255:101–107.Crossref, Medline, CAS, Google Scholar
- 14. Wittwer, C. T., M. G. Herrmann, A. A. Moss és R. P. Rasmussen. 1997. Continuous fluorescence monitoring of rapid cycle DNA amplification. BioTechniques 22:130–138.Link, CAS, Google Scholar