Investigating the borderline: mucinous tumours – O&G Magazine
Tumeurs borderline mucineuses ovariennes de type intestinal – perspective d’un pathologiste.
‘Les tumeurs mucineuses de l’ovaire sont parmi les néoplasmes ovariens les plus difficiles à interpréter pour les pathologistes chirurgicaux. » Hart WR.1
Les tumeurs mucineuses de l’ovaire représentent environ 10 à 15 % de toutes les tumeurs épithéliales primaires de l’ovaire. Ces tumeurs sont caractérisées par une différenciation mucineuse de l’épithélium de la muqueuse et englobent un spectre allant des cystadénomes bénins et des cystadénofibromes aux carcinomes. Il existe une variation géographique de l’incidence, les tumeurs mucineuses étant comparativement plus fréquentes en Asie que dans les populations occidentales.2 Des changements importants dans les critères de classification et de diagnostic se sont produits au cours des 20 dernières années. Des controverses subsistent sur certains aspects de la classification et des résultats.
La catégorie des tumeurs borderlines a été introduite en 1971, pour identifier un sous-ensemble de tumeurs présentant des caractéristiques histologiques intermédiaires entre les tumeurs bénignes et malignes. Ces tumeurs présentent une prolifération épithéliale supérieure à celle observée chez leurs homologues bénignes, mais n’ont pas la croissance destructrice des carcinomes invasifs. Ce sous-groupe est associé à un résultat nettement meilleur que les carcinomes invasifs. Les termes synonymes comprennent une tumeur mucineuse à faible potentiel malin, un cystadénome à tumeur maligne limite et une tumeur proliférative atypique. Le terme « tumeur limite » a été adopté par l’OMS.3 La majorité (environ 85 à 90 %) des tumeurs borderlines mucineuses sont tapissées par un épithélium présentant une différenciation intestinale, généralement sous la forme de cellules caliciformes; cependant, il existe souvent un spectre de types cellulaires. Le reste est tapissé de cellules épithéliales ressemblant à l’épithélium endocervical (mullérien). Ces deux sous-groupes semblent distincts, avec des caractéristiques épidémiologiques et cliniques différentes.
Les MTB de type intestinal surviennent principalement chez les femmes en âge de procréer avec une moyenne de 45 ans; cependant, la tranche d’âge est large (entre neuf et 88 ans).1;2 Elles sont presque toujours unilatérales, cinq pour cent seulement ayant lieu de manière bilatérale. Les MTB sont généralement les plus grandes de toutes les tumeurs ovariennes et peuvent mesurer jusqu’à 30 cm de dimension (voir Figure 1). Les apparences grossières ne permettent pas de distinguer de manière fiable les tumeurs bénignes, limites et malignes. Typiquement, la surface coupée montre plusieurs kystes remplis de mucine, souvent d’aspect gélatineux (voir Figure 2).
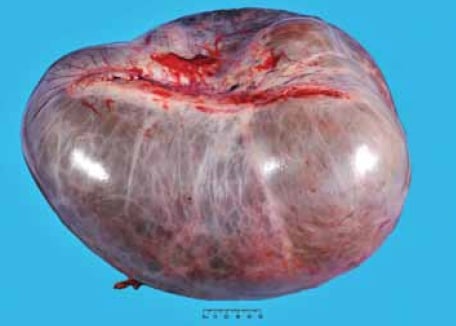
Figure 1. Les tumeurs limites mucineuses peuvent être très importantes. Cette tumeur mesurait 38 cm de dimension maximale.
Tumorigenèse
La cellule d’origine de la plupart des tumeurs mucineuses ovariennes primaires n’est pas claire. Ces tumeurs sont distinctes des autres tumeurs épithéliales ovariennes, avec des profils morphologiques, immunohistochimiques et moléculaires différents. Environ cinq pour cent sont associés à des tératomes kystiques (kystes dermoïdes) et peuvent être bénins, borderline ou maligns4 (voir Figure 3). Cette association suggère que certaines tumeurs mucineuses peuvent représenter des tératomes monodermiques d’origine germinale. Des tumeurs mucineuses occasionnelles sont également observées en association avec d’autres types de tumeurs ovariennes telles que les tumeurs de Brenner, les carcinoïdes et les tumeurs à cellules de Sertoli-Leydig (voir Figure 4). Une étude récente a émis l’hypothèse que les tumeurs mucineuses et de Brenner partagent une cellule d’origine dans les nids de cellules de transition situés à la jonction tubo-péritonéale.5 Les tumeurs d’aspect mucineux pur peuvent, dans certains cas, avoir dépassé et effacé toute tumeur de Brenner coexistante. 5 Les tumeurs d’aspect mucineux pur peuvent, dans certains cas, avoir dépassé et effacé toute tumeur de Brenner coexistante.
Les tumeurs mucineuses sont présumées se développer séquentiellement des cystadénomes bénins aux tumeurs borderlines et enfin aux carcinomes, semblables à une séquence adénome-carcinome observée dans l’intestin. Les stades intermédiaires sont les tumeurs borderlines avec carcinome intraépithélial (MBT avec IC) et les tumeurs borderlines avec carcinome microinvasion ou microinvasif (MBT avec IM). La preuve de cette hypothèse provient de l’apparence morphologique et des études moléculaires. Les tumeurs limites et malignes sont histologiquement hétérogènes, avec un spectre allant de bénignes à prolifératives et malignes, suggérant une progression. Des mutations K-ras ont été identifiées dans les tumeurs mucineuses et sont distinctes des mutations observées dans d’autres types de tumeurs ovariennes.Les mutations de 6 K-Ras ont été identifiées plus fréquemment dans les tumeurs malignes, par opposition aux tumeurs borderlines ou bénignes. Des mutations identiques ont été rapportées dans les zones bénignes, borderlines et malignes de la même tumeur.7,8 Cette mutation est un événement précoce présumé de la tumorigenèse.
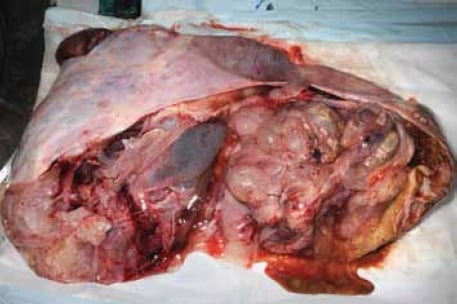
Figure 2. En règle générale, la surface coupée montre plusieurs kystes remplis de mucine.
Évaluation microscopique
Les MTB sont généralement composées de multiples kystes tapissés d’épithélium allant de bénins à prolifératifs avec stratification, zones de touffetage et croissance papillaire (voir Figures 5 et 6). Les cellules présentent une atypie légère à modérée et une activité mitotique. Les extrémités inférieure et supérieure du spectre ne sont pas bien définies. À l’extrémité inférieure, les tumeurs bénignes et borderlines se distinguent par le degré de prolifération épithéliale ou d’atypie. Des foyers de prolifération « mineurs » sont acceptables dans une tumeur bénigne, la prolifération dépassant dix pour cent étant utilisée par beaucoup, mais pas tous, comme une coupure quantitative arbitraire.9 Les tumeurs dont la prolifération est inférieure au seuil de dix pour cent sont désignées par cystadénomes mucineux à prolifération focale ou atypie focale. L’importance des moindres degrés de prolifération est incertaine, peu d’études abordant cette question.10
Le MBT à l’extrémité supérieure du spectre peut présenter soit un carcinome intraépithélial, soit de petits foyers d’invasion (microinvasion ou carcinome microinvasif).
MBT avec IC
Le carcinome intraépithélial est le précurseur présumé de la tumeur invasive et se caractérise par un épithélium présentant des zones d’atypie sévère (carcinome in situ) sans signe d’invasion. Si elle est présente, la tumeur doit faire l’objet d’un échantillonnage plus approfondi pour exclure l’invasion. Lorsque le carcinome intraépithélial est étendu, il peut être difficile de le distinguer de l’invasion avec un motif expansile.
MBT avec MI
Une microinvasion est rapportée dans jusqu’à neuf pour cent des tumeurs limites mucineuses de type intestinal.1 Les foyers invasifs peuvent être constitués de cellules uniques, de petits groupes, de glandes ou de foyers de croissance confluente ou cribriforme dans le stroma (voir Figure 6). La taille maximale admissible généralement acceptable de chaque foyer est de 10 mm2 de surface ou de 3 mm de dimension maximale. Certains chercheurs ont utilisé différentes dimensions maximales (2mm et 5mm).11,12 Si l’invasion dépasse ce seuil, la tumeur est classée comme carcinome. La taille maximale des foyers individuels n’a pas été validée, ni le nombre de foyers individuels admissibles n’a été spécifié.10 foyers de microinvasion doivent être distingués de l’extravascation de la mucine stromale après la rupture du kyste. Un épithélium fragmenté et non invasif peut être associé à ces granulomes de mucine.
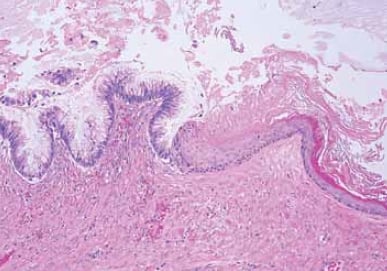
Figure 3. Des tumeurs mucineuses peuvent survenir en association avec des tératomes. Ce kyste est tapissé en partie par l’épithélium mucineux (à gauche) et par l’épithélium squameux stratifié kératinisant (à droite).
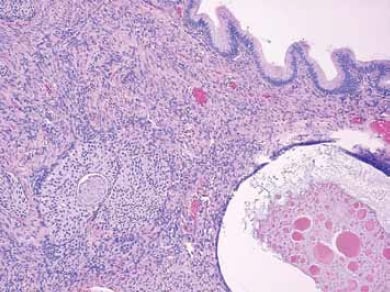
Figure 4. Les tumeurs mucineuses peuvent coexister avec les tumeurs de Brenner. Des nids de cellules de type transitoire typiques d’une tumeur de Brenner sont visibles dans le stroma ovarien sous un kyste tapissé d’un épithélium mucineux simple.
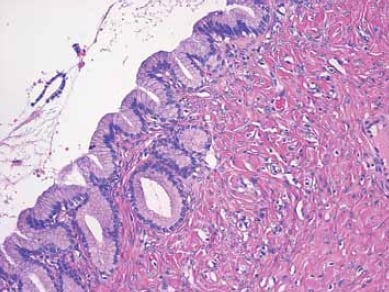
Figure 5. Ce kyste est tapissé d’un épithélium bénin constitué d’une seule couche de cellules présentant une différenciation mucineuse.
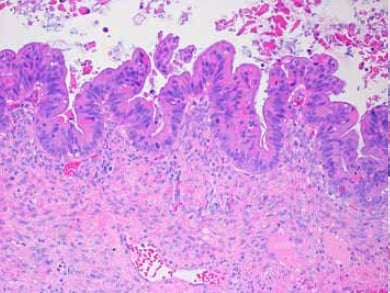
Figure 6. Tumeur limite mucineuse avec une zone de prolifération épithéliale présentant une stratification épithéliale, une atypie nucléaire et une activité mitotique.
Tumeurs borderlines avec nodules muraux
Les tumeurs mucineuses rares ont des nodules muraux qui peuvent être réactifs ou malins. Les nodules réactifs sont souvent multiples et peuvent survenir dans les tumeurs bénignes, borderlines ou malignes. Les nodules malins, en revanche, apparaissent presque toujours dans les tumeurs limites ou malignes. Ceux-ci peuvent être solitaires ou multiples et avoir un aspect carcinomateux, sarcomateux ou mixte. La présence d’une tumeur maligne est associée à un mauvais résultat.
Résultat
Les tumeurs borderlines de tous types ont généralement un pronostic extrêmement bon. L’analyse d’études plus récentes avec un examen histopathologique détaillé a montré un risque global de récidive de deux pour cent (1,2 pour cent, 1,9 pour cent et 5,1 pour cent dans la TMO sans caractéristiques histologiques indésirables, la TMO avec IC et la TMO avec MI, respectivement).13 La récidive est fortement associée au stade, et aucune femme présentant une tumeur au stade IA n’a récidivé, même lorsque des caractéristiques histologiques défavorables étaient présentes. Les femmes qui ont récidivé présentaient toutes des tumeurs au stade IC, avec des taux de récidive de 4,2 %, 16,7 % et 25 %, respectivement, dans les trois sous-groupes tumoraux. Bien que les chiffres globaux soient faibles, des décès liés aux tumeurs ont été observés. Un risque lié à l’âge a également été identifié, toutes les récidives se produisant chez les femmes âgées de < 45 ans.13 Ce risque lié à l’âge n’a pas été largement étudié.
Une classification correcte des tumeurs mucineuses nécessite un échantillonnage approfondi et l’exclusion des métastases. Les tumeurs sont généralement de grande taille et hétérogènes sur le plan histologique, ce qui nécessite un échantillonnage approfondi. Les recommandations actuelles sont de traiter enfin une section par centimètre de tumeur, avec un échantillonnage supplémentaire atteignant deux sections par centimètre dans les tumeurs de plus de 10 cm, ou avec des zones kystiques ou solides complexes, ou celles présentant un carcinome intraépithélial, une microinvasion ou une perforation tumorale.14 Ce niveau d’échantillonnage n’a pas été atteint dans de nombreuses études antérieures sur les résultats dans lesquelles un comportement agressif dans le MBT a été signalé.
La grande majorité des carcinomes mucineux, et certaines tumeurs d’aspect borderline, sont maintenant reconnus comme métastatiques à partir de sites extra-génitaux, en particulier du tractus gastro-intestinal. Les tumeurs du pancréas et des voies biliaires peuvent être particulièrement fades et histologiquement indiscernables des tumeurs limites mucineuses. La présentation avec une masse ovarienne peut précéder le diagnostic de la tumeur primaire. À la rare exception des tumeurs mucineuses associées à un tératome, le pseudomyxome péritoine (ascite mucineuse et / ou nodules péritonéaux mucineux) est invariablement dû à un néoplasme extra-ovarien, généralement appendiculaire, avec atteinte secondaire de l’ovaire.4 Lorsque les tumeurs métastatiques sont exclues, les carcinomes mucineux primaires sont très rares. L’immunohistochimie peut aider à l’interprétation du site probable d’origine tumorale, mais il existe un chevauchement considérable des immunoprofiles et une corrélation clinique est toujours nécessaire. Les caractéristiques favorisant les métastases comprennent la bilatéralité, la taille < 10 cm, l’atteinte superficielle par la tumeur ou la présence de mucine de surface, un schéma d’invasion infiltrant, un schéma de croissance nodulaire, des cellules à chevrons ou une invasion unicellulaire, une invasion vasculaire, une atteinte hilaire ovarienne, un pseudomyxome ovarii et un pseudomyxome péritoine. La nécrose sale est souvent associée à des tumeurs du côlon métastatiques. La connaissance des antécédents cliniques et des résultats radiologiques du patient est essentielle à l’évaluation.
Résumé
Notre compréhension de la pathogenèse et du comportement des tumeurs mucineuses de l’ovaire a considérablement évolué au cours des dernières décennies. L’excellent pronostic de la plupart des MTB a donné lieu à des suggestions pour que les MTB soient reclassées comme bénignes. D’autres pensent que ce terme devrait être conservé car il reflète mieux leur position intermédiaire dans la tumorigenèse.15 De plus, un certain nombre de controverses persistantes restent non résolues, en particulier celles concernant la signification clinique des caractéristiques histologiquement défavorables. Les données actuelles sur les résultats sont basées sur un petit nombre de patients. La stratification des tumeurs borderlines en tumeurs présentant ou non des caractéristiques histologiques indésirables permet d’étudier plus avant les résultats dans ces sous-groupes. Cela améliorera notre compréhension de ces tumeurs problématiques et aidera à orienter le suivi clinique et les recommandations à long terme.
- Hart WR. Tumeurs mucineuses de l’ovaire: Une revue. Int J GynecolPathol 2004; 24:4-25.
- Longacre T, Gilks CB. Tumeurs Stromales Épithéliales de surface de l’ Ovary.In Goldblum JR, éditeur. Pathologie gynécologique. Elsevier ChurchillLivingstone; 2009. P393-444.
- Lee KR, Tavassoli FA, Prat J et al. Épithélial-stromal de surface tumours.In Tavassoli FA, Devilee P, éditeurs. Tumeurs du sein et de la Femmeorganes génitaux. Presse du CIRC; 2003. P117-45.
- Vang R, Robe AM, Zhao C et al. Tumeurs mucineuses ovariennes associées à des tératomes kystiques matures. L’analyse morphologique et immunohistochimique a permis d’identifier un sous-ensemble d’origine teratomateuse potentielle qui partage les caractéristiques des tumeurs mucineuses du tractus gastro-intestinal inférieur plus couramment rencontrées dans l’ovaire. Am JSurg Pathol 2007; 31:854-69.
- Seidman JD, Khedmati F. Explorer l’histogenèse des néoplasmes des cellules ovariennesmucineuses et de transition (Brenner) et leur relation avec les nids de cellules de Walthard: une étude de 120 tumeurs. ArchPathol Lab Med 2008; 132: 1753-60.
- Kurman RJ, Shih IM. Pathogenèse moléculaire et origine extraovariale du cancer de l’ovaire épithélial – Changer le paradigme. Hum Pathol2011; 42; 918-31.
- Mandai M, Konishi I, Kuroda H et al. Distribution hétérogène de l’Épithélium Muté K-ras dans les Tumeurs Ovariennes Mucineuses Avec une Spécialeférence à l’Histopathologie. Hum Pathol 1998; 28:34-40.
- Cuatrecasas M, Villanueva A, Matia-Guiu X, et al. Mutations K-ras dans les tumeurs ovariennes mucineuses: une étude clinicopathologique et moléculaire de95 cas. Cancer 1997; 79:1581-6.
- Ronnett BM, Kajdacsy-Balla A, Gilks CB et al. Tumeurs Ovariennes Borderlines Mucineuses: Points d’accord général et de Controverses Persistantes Concernant la Nomenclature, les Critères Diagnostiques et le comPortement. Hum Pathol 2004; 35:949-60.
- Silverberg SG, Bell DA, Kurman RJ et al. Tumeurs Ovariennes Borderline: Points clés et Résumé de l’Atelier. Hum Pathol 2004; 35:910-17.
- Nomura K, Aizawa S. Carcinomes non invasifs, microinvasifs et invasifs de l’ovaire: une analyse clinicopathologique de 40cas. Cancer 2000; 89:1541-6.
- Riopel MA, Ronnett BM, Kurman RJ. Evaluation des critères diagnostiques et du comportement des tumeurs mucineuses de type intestinal ovarien : tumeurs atypiques à prolifération (limites) et carcinomes intraépithéliaux, microinvasifs, invasifs et métastatiques. Am J Surg Pathol 1999; 23:617-35.
- Khunamornpong S, Settakorn J, Sukpan K et al. Tumeur Mucineusede Faible Potentiel Malin (Tumeur ”Borderline » ou ”Proliférative Atypique ») de l’Ovaire: Une étude de 171 Cas Avec l’Évaluation Deconcinome Intra-épithélial et Microinvasion. Int J Gynecol Pathol2011; 30:218-30.
- Seidman JD, Soslow RA, Vang R et al. Tumeurs Ovariennes Borderline: Divers Points de Vue Contemporains sur la Terminologie et les Critères de diagnostic Avec des Images illustratives. Hum Pathol 2004; 35:918-33.
- Rodriguez IM, Prat J. Tumeurs Mucineuses de l’Ovaire: Analyse AClinicopathologique de 75 Tumeurs borderlines (de type intestinal) et Carcinomes. Am J Surg Pathol 2002; 26(2): 139-52.