Effet ionique commun
Science >Chimie >Chimie physique > Équilibres ioniques > Effet ionique commun
Dans cet article, nous étudierons l’effet ionique commun et ses applications.
Le phénomène dans lequel le degré de dissociation de tout électrolyte faible est supprimé en ajoutant une petite quantité d’électrolyte fort contenant un ion commun est appelé effet ionique commun.
Exemple 1: (Dissociation d’un acide faible)
L’ionisation de l’acide acétique à électrolyte faible (CH3COOH) est supprimée en ajoutant de l’acétate de sodium à électrolyte fort (CH3COONa) contenant un ion acétate commun (CH3COO–)
Explication:
Supposons qu’un acide acétique à électrolyte (CH3COOH) soit traité avec de l’eau. Il se dissocie et un équilibre existe comme suit,
CH3COOH(aq) ⇌CH3COO–(aq) +H+(aq)
En appliquant la loi de l’action de masse,
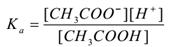
Où ‘Ka’ est la constante de dissociation de l’acide.
Si une petite quantité d’un électrolyte fort comme l’acétate de sodium (CH3COONa) est ajoutée à la solution aqueuse de CH3COOH, elle se dissocie et l’équilibre existe, car
CH3COONa(aq) → CH3COO–(aq) + Na + (aq)
Ici, les ions CH3COO–sont communs, d’où leur concentration augmente. Selon le principe de Le-Chatelier, l’équilibre se déplace vers la gauche. Pour maintenir la valeur de Ka constante, la concentration de molécules de CH3COOH est augmentée. De cette façon, l’ionisation du CH3COOH est supprimée par l’ajout de CH3COONa. Ainsi le pH de la solution augmente.
Exemple 2: (Dissociation d’une base faible):
L’ionisation de l’hydroxyde d’ammonium à électrolyte faible (NH4OH) est supprimée en ajoutant du chlorure d’ammonium à électrolyte fort (NH4Cl) contenant de l’ion ammonium commun (NH4+)
Explication:
Supposons qu’un hydroxyde d’ammonium à électrolyte (NH4OH) soit traité avec de l’eau. Il se dissocie et un équilibre existe comme suit,
NH4OH(aq) ⇌ NH4 +(aq) + OH–(aq)
En appliquant la loi de l’action de masse,
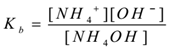
Où ‘Kb’ est constante de dissociation de la base.
Si une petite quantité d’un électrolyte fort comme le chlorure d’ammonium (NH4Cl) est ajoutée à la solution aqueuse de NH4OH, elle se dissocie et l’équilibre existe, car
NH4Cl (aq) → NH4+ (aq) + Cl–(aq)
Ici, les ions NH4+ sont communs, d’où leur concentration augmente. Selon le principe de Le-Chatelier, l’équilibre se déplace vers la gauche. Pour maintenir la valeur de Kb constante, la concentration de molécules de NH4OH est augmentée. De cette façon, l’ionisation du NH4OH est supprimée par l’ajout de NH4Cl. Ainsi le pH de la solution diminue.
Applications de l’Effet Ionique commun:
Purification du sel commun:
Principe:
L’ajout d’ion commun à une solution saturée de sel provoque la précipitation du sel. Lorsque le produit ionique dépasse le produit de solubilité, une précipitation a lieu.
Processus et explication:
Une solution saturée de sel commun, exempte d’impuretés suspendues, est prélevée et du gaz HCl y est passé. Dans une solution saturée de NaCI impur, l’équilibre existe comme suit,
NaCl(aq) → Na + (aq) + Cl–(aq)
Si du gaz HCI pur est passé à travers cette solution, étant un électrolyte fort, il se dissocie presque complètement et l’équilibre existe,
HCl(aq) → H + (aq) + Cl–(aq)
Maintenant Cl– est un ion commun. La concentration des ions CI (ions communs) est augmentée. Selon le principe de Tole-Chatelier, l’équilibre se déplace vers la gauche. La dissociation du NaCI est supprimée et le NaCI pur est précipité sous forme de sel solide. Ainsi, le NaCI pur peut être précipité en faisant passer du gaz HCI dans la solution saturée de NaCI impur.
Salage du savon:
Principe:
L’ajout d’ion commun à une solution saturée de sel provoque la précipitation du sel. Lorsque le produit ionique dépasse le produit de solubilité, une précipitation a lieu.
Processus et Explication:
Le savon est un sel de sodium d’acides gras supérieurs (RCOONa). Il est préparé par hydrolyse des huiles avec du NaOH. Dans une solution saturée de savon, il existe un équilibre,
ROONa(aq) → RCOO–(aq) + Na+(aq)
Si une petite quantité de NaCl est ajoutée à la solution savonneuse saturée, elle se dissocie lorsque
NaCl(aq) → Na+(aq) +Cl–(aq)
La concentration en ions Na+ (ion commun) augmente. En raison de l’effet ionique commun, la dissociation du savon est diminuée et le savon est précipité et peut ensuite être facilement retiré de la solution savonneuse. Ce processus consistant à obtenir du savon solide à partir d’une solution savonneuse, en ajoutant du sel comme le NaCI, s’appelle le salage du savon.