Basicité des Amines Et pKaH
Quantifiant La Basicité Des Amines, En Utilisant « La pKa De L’Acide Conjugué », alias « pKaH »
Comment mesurez-vous la basicité d’une amine? Exemple : qu’est-ce qu’une base plus forte: la pyridine ou la pipéridine?
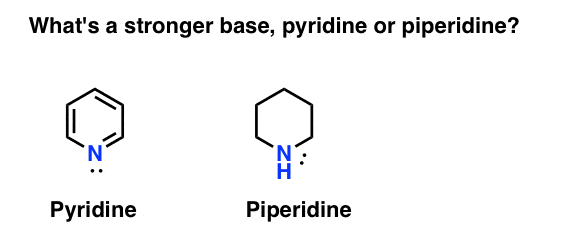
Si vous avez dit pipéridine, félicitations – c’est en effet une base plus forte.
Mais pourquoi ? Et combien plus fort? Comment essaie-t-on de répondre à ces questions? Après tout, nous pouvons facilement comparer la force des acides en examinant leurs pKa. Ne devrions-nous pas pouvoir faire de même avec les bases?
Oui, d’une certaine manière. Voici deux points clés pour aujourd’hui:
- La meilleure façon de quantifier la basicité d’une amine est d’examiner le pKa de son acide conjugué.
- Plus le pKa de l’acide conjugué est élevé, plus la base est forte.
Dans cet article, nous allons montrer quelques exemples spécifiques de l’utilisation des valeurs pKa pour comparer la basicité des amines.
Dans un post suivant, nous explorerons ensuite certaines tendances clés sous-jacentes à la basicité des amines.
Table des Matières
- Revue Rapide: Acides, Bases, Acides Conjugués Et Bases Conjuguées
- Utilisation De pKa Pour Mesurer L’Acidité
- Utilisation De pKa Pour Quantifier La Basicité Des Amines
- Le « pKa De L’Acide Conjugué” Peut Être Abrégé En « pKaH”
- Utilisation De pKaH Pour Déterminer Les Basicités Relatives Des Amines
- Quelques Mots De Prudence Sur Les Valeurs De pKa Pour Les Amines
- Quels Facteurs Clés Régissent La Basicité Des Amines?
- Notes
1. Examen Rapide: Acides, Bases, Acides Conjugués et Bases Conjuguées
Tout d’abord, passons rapidement en revue quelques bases de basicité.
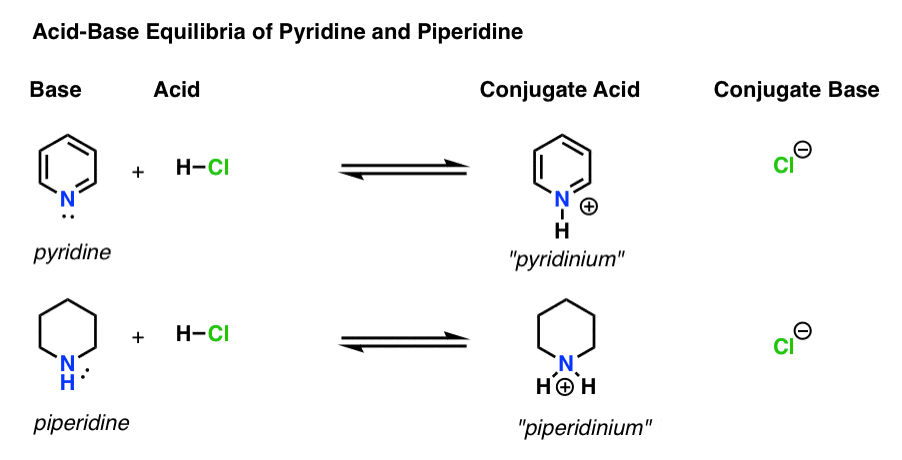
Il y a quatre acteurs dans chaque réaction acide-base.
- La base est l’espèce qui donne une paire isolée à H+ (également appelée « proton” ou « noyau d’hydrogène »). C’est là que se forme la nouvelle liaison avec H (par exemple pyridine, ci–dessous)
- L’acide conjugué est l’espèce qui résulte après que la base forme une liaison avec H (par exemple « pyridinium”, qui a une nouvelle liaison N-H)
- L’acide est l’espèce qui perd H+. C’est là que le lien avec H se rompt (par ex. H-Cl)
- La base conjuguée est l’espèce qui reste après que l’acide a donné H+ à la base (par exemple Cl-)
Voici la pyridine et la pipéridine en action. En suivant les liens qui se forment et se brisent, vous pouvez identifier chaque acteur.
2. En utilisant le pKa Pour Mesurer l’acidité
Chaque réaction acide-base peut être écrite comme un équilibre entre une réaction avant et une réaction inverse. Nous avons vu que la constante d’acidité, Ka, est une mesure de la facilité avec laquelle une espèce se dissocie pour donner H+ et la base conjuguée.
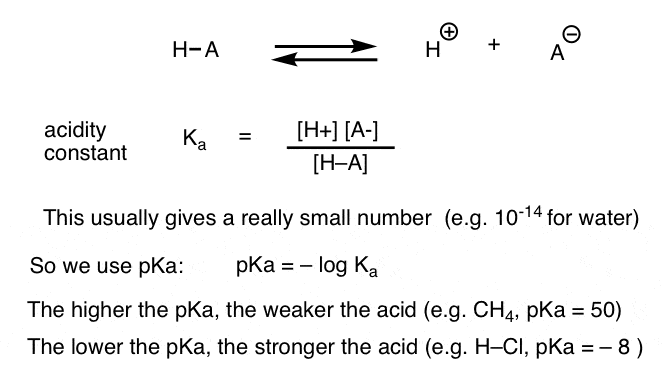
Pour plus de commodité, nous utilisons le log négatif de Ka, appelé pKa, qui est similaire à l’échelle de pH familière mais peut s’étendre au-delà de 14 car il n’est pas strictement limité au solvant aqueux. Les valeurs de pKa vont de -10 environ pour les acides très forts (par exemple l’acide iodique, H–I) à 50 et plus pour certains hydrocarbures (par exemple l’éthane).
Comment appliquer ces concepts pour mesurer la basicité ? Ne pourrions-nous pas changer les choses et définir un terme, Kb, qui est l’équilibre de la facilité avec laquelle une espèce se combine avec H +, définir pKb comme son log négatif et comparer les bases en regardant leurs valeurs pKb?
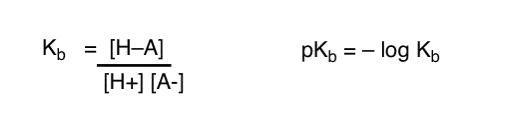
Oui…. on pourrait. Je suppose. S’il le fallait. Mais généralement, l’opinion des chimistes organiques sur ce sujet est « Vis pKb ».
Après tout, des valeurs de pKa ont été mesurées pour des milliers de molécules organiques. Est-ce que quelqu’un veut vraiment avoir à se souvenir d’un énorme ensemble de valeurs pKb aussi? Enfer non!
Au lieu de cela, nous pouvons facilement utiliser les valeurs pKa comme mesure indirecte de la basicité. Voici comment.
3. En utilisant les valeurs de pKa Pour Quantifier la basicité des Amines
Rappelez-vous ces deux lignes immortelles de prose, qui valent la peine d’être récitées tous les soirs:
- Plus l’acide est fort, plus la base conjuguée est faible.
- Plus l’acide est faible, plus la base conjuguée est forte.
Le pKa de l’acide conjugué de la pyridine (« pyridinium”) a été mesuré. C’est environ 5,2.
Nous avons également une valeur pour le pKa pour l’acide conjugué de la pipéridine. Il est environ 11 heures.
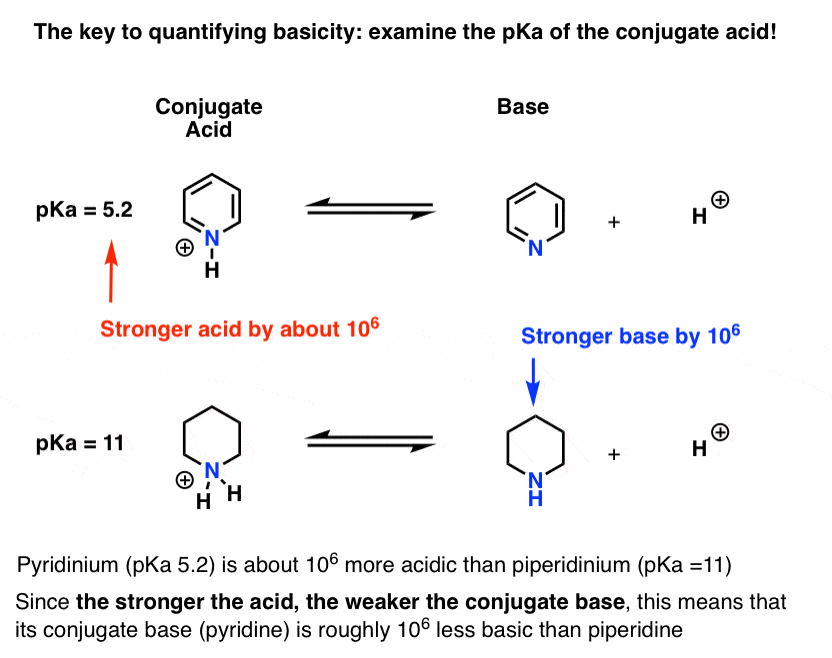
À partir de ces valeurs de pKa, nous pouvons dire que l’acide conjugué de la pyridine est plus fort que l’acide conjugué de la pipéridine d’environ 6 unités pKa. Puisque chaque unité pKa représente un facteur de 10, c’est un facteur d’environ 1 million.
Puisque « plus l’acide est fort, plus la base conjuguée est faible », la pyridine est donc une base plus faible que la pipéridine d’un facteur 1 million.
4. « Le pKa De L’Acide conjugué” Peut être Abrégé en « pKaH”
Le terme « pKa de l’acide conjugué” est un peu une bouchée à utiliser régulièrement. Étant naturellement paresseux, nous aimerions condenser un peu cela pour un usage courant.
Puisque l’acide conjugué d’une base (« B”) est « BH”, on peut abréger « le pKa de l’acide conjugué d’une base” comme son pKaH.
Ceci nous permet de dire que la pKaH de la pyridine est 5,2 et la pKaH de la pipéridine est 11.
Nous pouvons ensuite fouiller dans la littérature pour trouver d’autres bases pour la comparer.
Par exemple, à quel point l’ammoniac (NH3) est-il basique ? L’acide conjugué de l’ammoniac, NH4 (+), est de 9,2. De manière équivalente, on peut dire que le pKaH de l’ammoniac est de 9,2. Cela le place entre la pyridine et la pipéridine sur l’échelle de basicité.
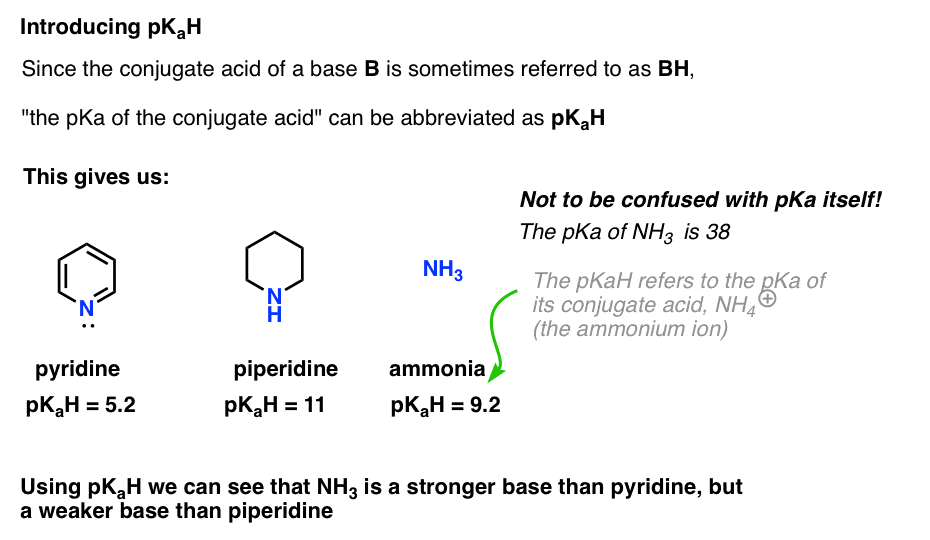
Notez qu’il est très important de ne pas confondre pKaH avec pKa. La pKaH de l’ammoniac est de 9,2, ce qui mesure l’acidité de son acide conjugué, NH4 (+).
Le pKa de l’ammoniac lui-même est de 38, ce qui mesure la constante d’équilibre pour la dissociation de NH3 pour donner sa base conjuguée, NH2 (-) et H+.
Cela signifie que 38 est le pKaH de l’ion amide NH2 (–), que vous avez peut-être déjà rencontré comme base forte (NaNH2) utilisée pour déprotoner les alcynes terminaux (pKa = 25). En utilisant pKaH, nous pouvons déterminer que NH2(–) est d’environ (38– 9) = 29 ordres de grandeur plus basiques que NH3!
5. Utiliser pKaH pour Déterminer les Basicités Relatives des Amines
Utiliser pKaH pour déterminer les forces relatives des bases est une astuce très utile.
Voici quelques exemples représentatifs de molécules azotées. Voici le pKa de leurs acides conjugués.
Quelle est la base la plus solide ici? Quel est le plus faible?
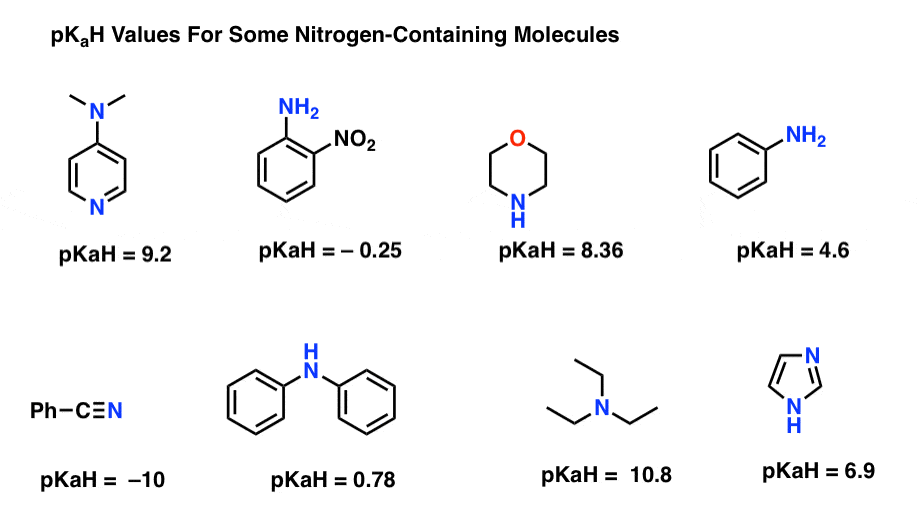
La valeur de pKaH la plus basse ici est -10 pour le nitrile (en bas à gauche). Cela signifie que le nitrile est la moins basique de toutes ces molécules.
La valeur pKaH la plus élevée ici est de 10,8 pour la triéthylamine. Cela fait de la triéthylamine la base la plus forte de toutes celles énumérées.
Quelques mots d’avertissement Sur Les valeurs de pKa Pour Les Amines
Deux choses à surveiller, en particulier lors de la lecture d’autres sources en ligne sur ce sujet.
Tout d’abord, les valeurs pKaH pour les amines sont parfois rapportées sous forme de valeurs pKa, sans explication. Les meilleures tables pKa ne le feront pas, mais il est difficile de trier le blé de l’ivraie lorsque vous débutez.
Si vous voyez une valeur pKa anormalement basse pour une amine, cela fait probablement référence à la pKaH de l’acide conjugué.
Par exemple, voici une table de pKa où le pKa de la méthylamine (CH3NH2) est répertorié comme 10,63.
C’est bas. Espérons qu’à ce stade, une telle valeur de 10 pour un pKa d’une amine devrait vous sembler étrange, d’autant plus que le pKa du NH3 étroitement lié est 38.
La valeur de 10,63 se réfère en fait au pKa de l’acide conjugué de la méthylamine, ET NON à la méthylamine elle-même. C’est une valeur pKaH.
De même, le même tableau répertorie la triméthylamine comme ayant un pKa de 9,8. Encore une fois, c’est en fait son pKaH. Je ne trouve pas de valeur pKa réelle pour la triméthylamine, mais je suppose qu’il s’agit de > 40, car la base conjuguée de la triméthylamine est le carbanion (CH3) 2N–CH2 (–)).
Une deuxième source de confusion, moins courante, est que parfois la pKaH d’une amine est signalée comme sa pKb, comme dans ce tableau qui rapporte la pKb de NH3 comme 9,2. C’est inexact.
Encore une fois, les valeurs pKb n’apparaissent pas vraiment beaucoup en chimie organique de premier cycle, bien qu’on me dise qu’elles apparaissent parfois sur le DAT / MCAT.
7. Quels Facteurs Clés Régissent La Basicité Des Amines ?
Maintenant que nous avons appris au moins comment quantifier et interpréter les valeurs de pKa des amines et de leurs acides conjugués, nous pouvons commencer à nous poser la question clé: pourquoi? Quels facteurs clés régissent la basicité des amines ? Quelles sont les tendances importantes ?
Par exemple, pourquoi la pyridine est-elle une base plus faible que la pipéridine? Pourquoi les nitriles sont-ils des bases encore plus faibles? Pourquoi les groupes de retrait d’électrons ont-ils tendance à rendre les amines plus faibles?
La bonne nouvelle est que si vous comprenez déjà les facteurs qui régissent l’acidité, il vous suffit d’appliquer exactement les mêmes principes – mais à l’envers!
Nous en parlerons dans le prochain article. Cinq facteurs Qui Affectent La basicité des Amines
Notes
Note de bas de page 1. Il y a beaucoup d’acides qui sont des non-bases (comme NH4 qui n’a pas de paire isolée) et beaucoup de bases qui sont des non-acides, comme Cl(–), qui est incapable d’accepter une paire isolée. Par conséquent, dire « plus l’acide est fort, plus la base est faible” est faux.
Note de bas de page 2. C’est la mesure obtenue en utilisant de l’eau comme solvant. Vous pouvez voir une autre valeur, 3,4, qui est obtenue lorsque le diméthylsulfoxyde (DMSO) est utilisé comme solvant. Voir les tables pKa de Bordwell (DMSO)