Apprenant en chimie
Qu’est-ce qu’une Liaison Covalente de Coordonnées?
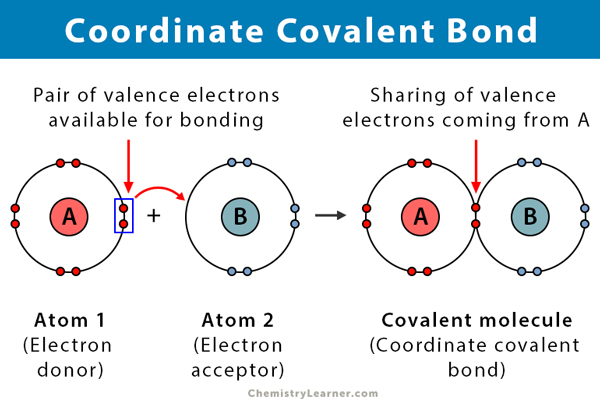
Une liaison covalente se forme lorsque deux atomes partagent des électrons. Une liaison covalente coordonnée, également connue sous le nom de liaison covalente dative, est un type de liaison covalente dans laquelle la paire d’électrons partagée provient de l’un des atomes. Les atomes sont maintenus ensemble car les deux noyaux attirent la paire d’électrons. Une fois la liaison covalente formée, il est impossible de distinguer l’origine des électrons. Ce type de liaison est généralement observé dans la liaison d’ions métalliques à des ligands. Cependant, les non-métaux peuvent également participer à cette liaison. La réaction entre l’acide de Lewis et la base est une liaison covalente coordonnée.
Un ion complexe est composé de deux choses, un ion métallique et des composés appelés ligands. Les ligands sont des molécules neutres ou des ions contenant des paires d’électrons solitaires qui peuvent se lier à l’ion métallique. Les ligands communs sont l’ammoniac (NH3), l’eau (H2O) et les ions halogénures (Cl–, Br–). Les ligands sont considérés comme des bases de Lewis car ils partagent leurs paires d’électrons avec l’ion métallique. Les ions métalliques sont toujours positifs, ils sont donc très attrayants pour les paires d’électrons isolées.
Faits et propriétés de la Liaison Covalente de coordonnées
La liaison covalente de coordonnées a de nombreuses propriétés similitudes avec celle de la liaison covalente. Voici quelques-unes de ses propriétés:
- Se produit entre un donneur d’électrons et un accepteur d’électrons, typiquement entre un métal et un ligand
- Se produit entre des atomes dissemblables
- Formés par le partage d’électrons donnés par l’un des atomes
- Rigides et directionnels
- Polaires
- Les atomes suivent la règle de l’octet
- L’atome qui donne les électrons est appelé donneur, et l’atome qui les accepte est appelé accepteur.
- Les composés sont peu solubles dans l’eau
Exemples de liaison covalente de coordonnées
Voici quelques exemples de molécules où une liaison covalente de coordonnées existe.
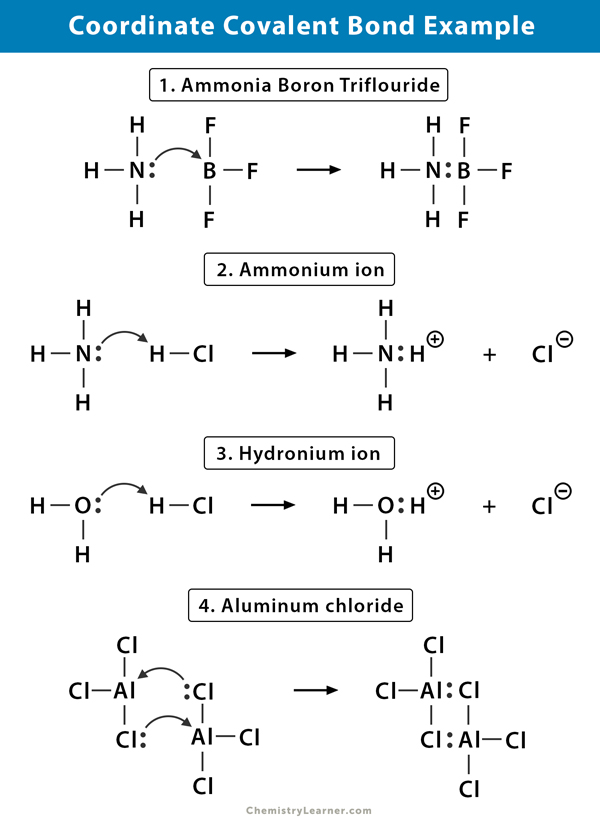
Ion ammonium (NH4+)
L’ion ammonium est formé à partir de la réaction du gaz ammoniac (NH3) avec du gaz chlorure d’hydrogène (HCl). Dans NH4+, le quatrième hydrogène est attaché par une liaison covalente coordonnée car seul le noyau de l’hydrogène est transféré du chlore à l’azote. L’électron de l’hydrogène est laissé sur le chlore pour former un ion chlorure négatif (Cl–).
Le trifluorure de bore ammoniac (NH3.BF3)
Le trifluorure de bore (BF3) est un composé qui n’a pas de structure de gaz noble autour de l’atome de bore (B). Le bore n’a que trois paires d’électrons dans sa coquille de cantonnière et nécessite une paire pour compléter l’orbitale. Par conséquent, BF3 est déficient en électrons. La paire unique sur l’azote (N) de la molécule d’ammoniac (NH3) est utilisée pour surmonter cette carence, et un composé complexe se forme par une liaison covalente coordonnée.
Ion hydronium (H3O+)
Lorsque le chlorure d’hydrogène (HCl) gazeux se dissout dans l’eau pour former de l’acide chlorhydrique (HCl aq.), une liaison covalente coordonnée se forme dans l’ion hydronium. Le noyau d’hydrogène (H) est transféré à la molécule d’eau (H2O), qui a une seule paire d’électrons pour former de l’hydronium. Ainsi, H ne contribue pas d’électrons à la liaison.
Chlorure d’aluminium (Al2Cl6)
La liaison dans le chlorure d’aluminium (AlCl3) est essentiellement covalente. Chaque atome d’aluminium (Al) a un déficit de deux électrons dans sa coquille de cantonnière, et le chlore (Cl) a une seule paire. Al forme une liaison covalente coordonnée avec l’atome Cl sur un groupe AlCl3 adjacent. Comme chacun des deux atomes d’Al le fait, le chlorure d’aluminium est une molécule de dimère covalente de formule Al2Cl6.
Monoxyde de carbone (CO)
Le carbone (C) a quatre électrons dans sa coquille de valence et l’oxygène (O) en a six. Le carbone et l’oxygène partagent leurs deux électrons. Alors que la règle de l’octet est satisfaite de l’oxygène, il y a toujours un déficit de deux électrons sur le carbone. Ainsi, l’oxygène partage ses deux électrons avec le carbone pour former une liaison covalente coordonnée, en plus des deux liaisons covalentes régulières (doubles).