yhteinen Ioniefekti
tiede > kemia > Fysikaalinen kemia > ioninen tasapainotila > ioninen tasapainotila>yhteinen ioniefekti
tässä artikkelissa tutkitaan yhteistä ioniefektiä ja sen sovelluksia.
ilmiötä, jossa heikon elektrolyytin dissosiaatioaste vaimenee lisäämällä pieni määrä vahvaa elektrolyyttiä, joka sisältää yhteisen ionin, kutsutaan yleiseksi ioniefektiksi.
Esimerkki – 1: (heikon elektrolyytin etikkahapon (CH3COOH) dissosiaatio
heikon elektrolyytin etikkahapon (CH3COOH)ionisaatio tukahdutetaan lisäämällä siihen vahvaa elektrolyyttinatriumasetaattia (CH3COONa), joka sisältää tavallista asetaatti–Ionia (CH3COO -)
selitys:
Oletetaan, että elektrolyytin etikkahappo (CH3COOH) isstreated veden kanssa. Se dissosioituu ja tasapaino on olemassa seuraavasti:
CH3COOH(aq) ⇌CH3COO–(aq) + H+(aq)
soveltamalla joukkotoiminnan lakia,
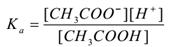
missä ” ka ” on hapon dissosiaatiovakio.
Jos CH3COOH: n vesiliuokseen lisätään pieni määrä vahvaa elektrolyyttiä, kuten natriumasetaattia (CH3COONa), se dissosioituu ja tasapaino on olemassa, sillä
CH3COONa(aq) → CH3COO–(aq) + Na+(aq)
tässä CH3COO– ionit ovat yleisiä, jolloin niiden pitoisuus kasvaa. Le-Chatelierin periaatteen mukaan tasapaino siirtyy vasemmalle. Ka: n arvon pitämiseksi vakiona CH3COOH-molekyylien konsentraatiota lisätään. Näin CH3COOH: n ionisaatio vaimennetaan lisäämällä siihen CH3COONa. Näin liuoksen pH kasvaa.
Esimerkki – 2: (heikon emäksen dissosiaatio):
heikon elektrolyytin ammoniumhydroksidin (Nh4oh)ionisaatio tukahdutetaan lisäämällä siihen vahvaa elektrolyyttiä ammoniumkloridia (NH4Cl), joka sisältää yhteistä ammoniumionia (NH4+)
selitys:
Oletetaan, että elektrolyytti ammoniumhydroksidi (Nh4oh)käsitellään vedellä. Se dissosioituu ja tasapaino on olemassa seuraavasti:
nh4oh(aq) ⇌ NH4+(aq) + OH–(aq)
soveltamalla joukkotoiminnan lakia,
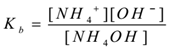
missä ” Kb ” on emäksen dissosiaatiovakio.
Jos nh4oh: n vesiliuokseen lisätään pieni määrä vahvaa elektrolyyttiä, kuten ammoniumkloridia (Nh4cl), se dissosioituu ja tasapaino on olemassa, koska
nh4cl(aq) → NH4+(aq) + Cl–(aq)
tässä NH4+ ionit ovat yleisiä, jolloin niiden pitoisuus kasvaa. Le-Chatelierin periaatteen mukaan tasapaino siirtyy vasemmalle. Kb: n arvon pitämiseksi vakiona nh4oh-molekyylien konsentraatiota lisätään. Näin nh4oh: n ionisaatio vaimenee lisäämällä siihen nh4cl. Näin liuoksen pH laskee.
yhteisen Ioniefektin Sovellukset:
tavallisen suolan Puhdistus:
periaate:
tavallisen ionin lisääminen kylläiseen suolaliuokseen aiheuttaa suolan saostumisen. Kun ionituote ylittää liukoisuustuotteen, saostuminen tapahtuu.
prosessi ja selitys:
otetaan tavallisen suolan tyydyttynyt liuos, jossa ei ole suspendoituja epäpuhtauksia, ja HCl-kaasu johdetaan sen läpi. Epäpuhtaan nacin saturoituneessa solussa tasapainotila on seuraava:
NaCl(aq) → Na+(aq) + Cl–(aq)
Jos puhdas HCI–kaasu johdetaan tämän liuoksen läpi, joka on vahva elektrolyytti, se hajoaa lähes kokonaan ja tasapaino on olemassa,
HCl(aq) → h+(aq) + Cl– (aq)
nyt CL-on yhteinen ioni. CI– ionien (tavallisten ionien) pitoisuus lisääntyy. ToLe-Chatelierin periaatteellinen tasapaino siirtyy vasemmalle. Naci: n dissosiaatio tukahdutetaan ja puhdas NaCI saostuu solidsaltiksi. Näin puhdas NaCI voidaan saostaa kuljettamalla HCI-kaasua epäpuhtaan NaCI: n tyydyttymättömässä liuoksessa.
suolaus saippuasta:
periaate:
tavallisen ionin lisääminen kyllästettyyn suolaliuokseen aiheuttaa suolan saostumisen. Kun ionituote ylittää liukoisuustuotteen, saostuminen tapahtuu.
prosessi ja selitys:
saippua on korkeampien rasvahappojen(RCOONa) natriumsuola. Sitä valmistetaan hydrolysoimalla öljyjä NaOH: n kanssa. Kyllästyneessä soap-liuoksessa vallitsee tasapainotila,
ROONa(aq) → RCOO–(aq) + Na+(aq)
Jos kyllästettyyn saippualiuokseen lisätään pieni määrä NaCl: ää, se dissosioituu, kun
NaCl(aq) → Na+(aq) + Cl–(Aq)
Na+ ionien (yhteinen ioni) pitoisuus kasvaa. Yleisen ioniefektin vuoksi saippuan dissosiaatio vähenee ja saippua saostuu, minkä jälkeen se voidaan helposti poistaa saippualiuoksesta. Tätä prosessia, jossa saippualiuoksesta saadaan kiinteää saippuaa lisäämällä suolaa kuten NaCI, kutsutaan saippuan suolaamiseksi pois.