FRET-TaqMan-koettimien suunnittelu multiplex-reaaliaikaista PCR: ää varten käyttäen sisäistä positiivista kontrollia
Johdanto
reaaliaikainen PCR mahdollistaa fluoriforifluoresenssin jatkuvan seurannan PCR-tuotteiden tuotannossa suljetussa putkimuodossa. Tällä hetkellä käytettävissä menetelmissä käytetään joko merkitty koettimet tai DNA interkalating väriaine seurata vahvistus PCR tuote. TaqMan-luotain on yksijuosteinen oligonukleotidi, joka sisältää fluoroforin ja kvencher 10-30 emästä toisistaan. Taqman-anturi hydrolysoituu vahvistuksen aikana fluoroforin sammuttajasta erottavan Taq-polymeraasin 5′ -3 ’ – kaksijuosteisen eksonukleaasiaktiivisuuden vuoksi, jolloin fluoresenssi lisääntyy. Reaaliaikaiset PCR-instrumentit on varustettu fluoresenssiilmaisimilla ja ohjelmistoilla, joilla voidaan arvioida syklin kynnys (Ct), jonka aikana fluoresenssi on suurempi kuin tausta-fluoresenssi, positiivisten reaktioiden osalta. Tekniikka ei kuitenkaan pysty erottamaan oikeaa negatiivista tulosta väärästä negatiivisesta, kun monistumisenestoaineet vaikuttavat PCR: ään. Nukleiinihapon uuttamisen jälkeen on raportoitu, että inhibiittorit voivat edelleen olla läsnä kliinisistä näytteistä (esim., hemoglobiini), ympäristönäytteistä (esim., humus-ja fulviinihapot), ja kemikaaleja, joita käytetään nukleiinihapon uuttamisen aikana (esim., etanoli, pesuaineet, tai chaotrooppiset aineet). Diagnostisten määritysten luotettavuutta lisää sisäisen kontrollin nukleiinihappo, joka voi osoittaa PCR-estäjien läsnäolon ja vaikutuksen (1,2). Sisäinen positiivinen kontrolli (IPC) monistetaan samanaikaisesti kohdesekvenssin läsnä ollessa käyttäen merkittyä fluoriforia, joka lähettää valoa eri aallonpituudella kuin kohdesekvenssimäärityksessä käytetty fluorofori, ja nämä kaksi fluoriforia havaitaan eri kanavissa reaaliaikaisella PCR-laitteella. PCR: n yleisesti käytetty sisäinen kontrolli on plasmidi, joka sisältää näytteenottoaluetta lukuun ottamatta samanlaisen sekvenssin kuin määrityskohde. Yksittäiseen määrityskohteeseen lisätään rajallinen määrä IPC-molekyylejä, jotka monistetaan yhdessä kohde-nukleiinihapon kanssa; positiivinen IPC-signaali on siis todiste siitä, että amplifikaatioreaktio eteni riittävästi synnyttämään positiivisen signaalin hyvin pienistä määristä kohdenukleiinihappoa. Tämä ominaisuus on tärkeä IPC: n ja kohdenukleiinihapon (3-9) ekvivalentin vahvistumisen varmistamiseksi. Kuitenkin jotkut laitteet—kuten LightCycler 1.2 ja LightCycler 2 (Roche Applied Science, Indianapolis, IN, USA), Ruggedized Advanced Pathogen Identification Device (R. A. P. I. D.) instrument (Idaho Technology, Salt Lake City, UT, USA) ja handheld real-time PCR instruments—on varustettu vain yhdellä valonlähteellä ja siihen liittyvällä päästökanavalla. Multiplexing tämäntyyppisten instrumenttien edellyttää monimerkittyjen oligonukleotidien ja fluoresenssi resonanssi energian siirto (FRET) käsite. Kuitenkin tuskailla koettimet voi olla haastavaa suunnitella ja voi puuttua kestävyyttä hypervariable alueilla ja kun ei-optimaalinen vahvistus olosuhteet ovat läsnä. FRET-koettimien käyttö edellyttää kahden alueen tunnistamista kahdelle koettimelle. Tuskailla koetin järjestelmä nojaa vierekkäisten hybridisaatio oligonukleotidien kahden yhden merkitty koettimet siten fluoresenssi hyväksyttävän väriaineen havaitaan magnetointi fluorofori kiinnitetty toiseen koetin. Suuri haitta tuskailla koetin on vaatimus suuremman sekvenssin alueella tarpeen sijoittaa kaksi vierekkäistä koettimet aukko 2-5 nukleotidien. Multipleksointimahdollisuus on olemassa muiden merkintäjärjestelmien kanssa, kuten MegaStokes dye (DYXL; Dyomics, Jena, Saksa) ja Pulsar 650 (Biosearch Technologies, Inc., Novato, CA, USA), mutta nämä merkintäjärjestelmät vaativat spektritietoa kanavan ylikuulumisen kompensoimiseksi, eivätkä ne ole laajalti saatavilla. Tässä tutkimuksessa kehitetty FRET-TaqMan-koetin ei kuitenkaan vaadi värikorvausohjelmistoja ja käyttää fluoriforeja (Fam, Cy5.5), jotka ovat laajalti saatavilla. Tässä raportissa keskitytään suunnitteluun kolminkertainen merkitty anturi mahdollistaa multiplexing instrumenteissa, joissa on vain yksi sininen valoa lähettävä diodi (LED) heräte lähde (470 nm) ja siihen liittyvät kolme vastaavaa havaitsemiskanavaa (esim., 530 nm, 640 nm, ja 705 nm).
materiaalit ja menetelmät
koettimen suunnitteluperiaate
kaikki kokeet tehtiin Idaho Technologyn R. A. P. I. D.-järjestelmällä, 32 näytettä sisältävällä kannettavalla reaaliaikaisella PCR-laitteella, joka on varustettu sinisellä LED-LEDillä magnetointia varten (470 nm) ja siihen liittyvällä kolmella fluoresenssin ilmaisukanavalla, jotka mittaavat fluoresenssia 530, 640 ja 705 nm: ssä mono-ja kaksivärimäärityksiä varten. Alukkeet JVAF ja JVAR (10) ja luotain 5′-FAM/BHQ-1 syntetisoitiin CDC biotekniikan ydinlaitoksessa (Atlanta, GA, USA) ja luotain 5 ’Fam-Cy5.5/3′ BHQ-3 syntetisoitiin Idaho Technologyssa. Duplex TaqMan PCR: n mahdollistamiseksi yksi anturi merkittiin 5’-FAM/BHQ-1: llä (520-nm fluoresenssin aallonpituus) ja toinen 5 ’Fam-Cy5.5/3’ BHQ-3: lla (705-nm fluoresenssin aallonpituus). Liuoksessa koetin, joka on merkitty 5 ’Fam-Cy5.5/3’ BHQ-3: lla, pysyy sammuneena hybridisaation jälkeen sekvenssiin, ja sen jälkeen, kun koetin pilkkoutuu entsymaattisella primer-laajennuksella, kvencher eliminoituu. Tämä johtaa tuskailla kautta magnetointi Fam valonlähteen R. A. P. I. D. väline. Heräteenergia siirretään acceptor fluoroforille, Cy5.5, ja emittoitunut fluoresenssi mitataan toisella fluoresenssikanavalla (R. A. P. I. D.-instrumentin fluoresenssikanava F3). Cy5. 5 fluoresenssin emissio on seurausta FRET – ja TaqMan-anturitekniikoiden yhdistelmästä, joten näitä kolmoismerkittyjä koettimia voidaan kutsua ”FRET-TaqMan”-koettimiksi.
alukkeet, koettimet ja plasmidi
osoittaaksemme fret-TaqMan-mallin multipleksointikyvyn käytimme genuskohtaista Cryptosporidium-reaaliaikaista PCR-määritystä vahvistaaksemme 159-bp: n osaa 18S rRNA-geenistä (10). Forward primer (JVAF) oli 5′-ATGACGGGTAACGGGAAT-3′, reverse primer (jvar) oli 5′-CCAATTACAAC-CAAAAGTCC-3′ ja TaqMan-luotain (Jvap) oli 5′-FAM-CGCGCCCTGCT-GCCTTAGATG–BHQ1-3′, joka vastaa nukleotideja 100-118, 258-236, ja 184-161, genbankin liittymisen nro. AY458612. Cryptosporidium IPC: n rakentamiseen tarkoitetut alukkeet sisälsivät samat alukesarjat, jotka raportoitiin Cryptosporidium SPP: n monistamiseksi., paitsi kohde-DNA: n koettimia sitova alue, joka korvattiin keinotekoisella sekvenssillä 5′-TTGTGTGTGTGT-3′ (JPIPC). Tämän luotaimen sekvenssin hehkutuslämpötila oli 69°C ja sillä ei ollut sekundäärirakennetta. Teoreettinen spesifisyys sisäiselle koettimelle varmistettiin räjäytyksellä (11) koettimen ja primer-sekvenssien etsinnällä, jossa ei löydetty tarkkaa vastaavuutta minkään Cryptosporidium-sekvenssin kanssa. IPC-fragmentti syntetisoitiin ja kloonattiin plasmidiksi integroidulla DNA-teknologialla (Coralville, IA, USA). Kaikkien muiden paitsi negatiivisessa kontrollissa tapahtuneiden reaktioiden pääaineseokseen lisättiin tunnettu plasmidi-DNA: n pitoisuus (100 kopiota/reaktio). IPC: lle ominainen kolmoismerkitty koetin (jpipc) syntetisoitiin Idaho-tekniikalla, kuten kuvassa 1 esitetään. Fam/Cy5.5 / BHQ3 oligo-nukleotidi-anturi syntetisoitiin alkaen 3 ’ – päästä ei-fluoresoivalla mustan aukon Quencher (BHQ-3) – ohjatulla huokoslasilla (CPG). Tämän jälkeen 5′-päähän konjugoitiin sy5.5-fosporamidiitti, jota seurasi terminaalinen 5’ – fluoreseiini (6-FAM) – fosporamidiitti.
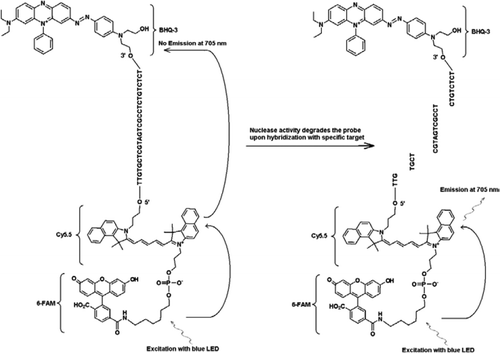
FRET-TaqMan-koettimessa on kolme tarraa: musta aukko-sammuttimen osa 3′ – varren päässä, emitterifluorofori (Cy5.5) ja harvesterifuorofori (Fam), jotka on liitetty yhteen sen 5′ – varren päässä. FAM imee tehokkaasti energiaa sinisestä ledistä valonlähteenä. Kohteiden puuttuessa luotain on pimeä, koska FAM: n absorboima energia siirtyy Cy5.5: een ja vastaavasti Cy5: stä vapautuva energia.5 siirretään sammuttajalle ja menetetään lämpöenergiana. Kohteiden läsnä ollessa TaqMan-luotain pilkkoutuu Taq-polymeraasin aktiivisuuden vaikutuksesta ja quencher vapautuu ja FAM: n absorboima energia siirtyy Cy5.5: een FRET-mekanismin kautta, joka säteilee fluoresenssia 705 nm: ssä.
reaaliaikainen PCR-määritys
Virtaussytometri lajitellut Cryptosporidium parvum-ookystit (200 ookystiä putkea kohti), saatu Wisconsinin yliopiston State Laboratory of Hygiene-laboratoriosta (Madison, WI, USA). C: n DNA: ta. parvum-ookystat uutettiin Hill et al: n kuvaamalla menetelmällä. (12) ja suspendoitu 80 µL Tris EDTA (TE, pH 8.0) – puskuriin. Reaktiota kohti lisättiin kaksi mikrolitraa DNA: ta, joka vastasi 5 ookystia (vastaten 100 kopiota kohde-DNA: ta). Monistusreaktioseos koostui Quantifast Probe PCR + ROX kit-reaktioseoksesta (Cat. nro 204354; Qiagen), johon ei ole lisätty ROX: ää, JVAF, jvar alukkeet (kukin 0,4 µM), JVAP-anturi (0,2 µM), JPIPC-anturi (0,2 µM) ja 100 IPC: n kopiota. Reaktiokapillaariin (Roche Diagnostics, Indianapolis, USA) lisättiin määräosa (2 µL) uutetusta DNA-näytteestä, joka sisälsi 18 µL reaktioseosta. C. parvum – genomi-DNA-positiivinen kontrolli (kuva 2, kuvaaja 1), plasmidin IPC (kuva 2, kuvaaja 2), positiivisen C. parvum-kontrollin ja IPC: n seos (kuva 2, kuvaaja 3) sekä nukleaasittomasta vedestä koostuva NTC-kontrolli (NTC). Ei. AM9932; Ambion, Foster City, CA, USA) DNA: n sijasta (kuva 2, juoni 4) otettiin mukaan jokaiseen kokeeseen. Protokolla kesti ∼30 min seuraavien PCR-ehtojen täyttämiseen: kuumakäynnistysdenaturointivaihe 95°C: ssa 3 minuutin ajan, sen jälkeen 45 sykliä 95°C: n denaturoinnissa 5 sekunnin ajan, 60°C: n hehkutuksessa 30 sekunnin ajan yhden fluoresenssin hankinnalla (lämpötilan ollessa 20°c/s). Fam: lle kirjattiin positiivinen tulos kanavalla F1 (530 nm) ja Cy5, 5 kanavalle F3 (705 nm). Amplifikaatioreaktiot suoritettiin kolmena kappaleena. Amplikonit (159 bp) visualisoitiin agaroosigeelielektroforeesilla ja Hehkuvihreällä nukleiinihappovärjäyksellä (eEnzyme, Gaithersburg, MD, USA) PCR-tuotteen spesifisyyden vahvistamiseksi.
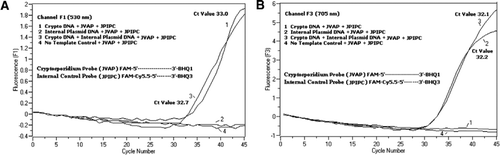
kaikkiin PCR-reaktioseoksiin lisättiin ekvimolaarinen seos Fam/BHQ1 ja Fam/Cy5.5/BHQ3. (A) kanavan F1-monitorit lisäävät FAM-fluoresenssia C. parvumin esiintyessä. Plot 1 (kanava F1 kerää ensisijaisesti FAM-signaalin) sisältää vain C. parvumin DNA paljasti PCR: ssä Cryptosporidium-spesifisen FAM-signaalin. Tontti 2 sisälsi vain plasmidin DNA: ta eikä Fam-signaalia Fam/Cy5.5/BHQ3-luotaimelta. Kuva 3 sisälsi sekä C. parvum ja plasmidi-DNA, mutta tuotti vain C. parvum-spesifisen FAM-signaalin. Havaintoala 4 oli negatiivinen näyte, joka sisälsi vain nukleaasitonta vettä minkä tahansa templaatti-DNA: n sijasta; luotaimista ei havaittu fluoresenssia. (B) kanava F3 näytöt kasvaa Cy5.5 läsnäolo sisäisen kontrollin plasmidi DNA. Kuvaaja 1 sisälsi vain C. parvumin DNA: ta eikä Fam/ BHQ1-luotaimen fluoresenssisignaalia. Tontti 2 (kanava F3 kerää ensisijaisesti Cy5.5–signaalin), joka sisältää vain plasmidi-DNA: ta, joka paljastaa PCR: ssä sisäisen plasmidiohjauksen (IPC) Cy5.5-signaalin. Kuva 3 sisälsi sekä C. parvum ja plasmidi-DNA, mutta tuottivat vain IPC-spesifisen Cy5. 5-signaalin. Havaintoala 4 oli negatiivinen näyte, joka sisälsi vain nukleaasitonta vettä minkä tahansa templaatti-DNA: n sijasta; luotaimista ei havaittu fluoresenssia.
tulokset ja keskustelu
reaaliaikaiset PCR-fluoresenssisignaalit, jotka heijastavat C: n monistumista.parvum-genomin DNA havaittiin F1-kanavassa (Kuva 2a) taqman-anturin FAM-merkintöjen vuoksi. IPC: n vahvistusta heijastava fluoresenssisignaali havaittiin F3-kanavassa (Kuva 2b) Fam/Cy5: n vuoksi.5 IPC TaqMan-koettimen merkinnät. Tämä luotain sai aikaan sy5.5: n kasvun F3-kanavassa (Cy5.5), mutta ei FAM: n lisääntymistä F1-kanavassa (Fam), kun BHQ3 erotetaan Fam/Cy5.5: stä nukleaasiaktiivisuuden vuoksi, koska energia siirtyi FAM: stä Cy5.5: een. Vastaavasti duplex-reaktiossa havaittiin F1-kanavassa C. parvumin genominen DNA-vahvistus, kun taas IPC-vahvistus havaittiin samanaikaisesti F3-kanavassa. FAM: n eksitaatio on 495 nm ja emissio 520 nm. Cy5.5: ssä on 690 nm: n magnetaatio ja 705 nm: n emissio. Kun Cy5.5: n ja FAM: n välinen etäisyys on näin lähellä kolmoismerkittyä IPC-anturia, Cy5.5: n fluorofori säteilee fluoresenssia, koska Fam: n fluorofori siirtää energian kokonaan, jolloin FAM: n fluoresenssiemissiota F1-kanavassa ei synny (Kuva 2a). Negatiivisissa kontrollireaktioissa ei havaittu fluoresenssin lisääntymistä FAM: n tai Cy5.5: n vuoksi. Nämä tulokset osoittavat myös, että yksi sininen (470 nm) LED-lähde riittää F1 – (530 nm) ja F3 – (705 nm) kanavien kautta tapahtuvien fluoresenssipäästöjen seurantaan ilman, että FAM: n ja Cy5.5: n valvontakanavissa on spektrisiä päällekkäisyyksiä. FRET-TaqMan-tekniikkaa testattiin myös 12 DNA-uutteen paneelilla ulostenäytteistä (8 näytteistä, jotka oli aiemmin määritetty positiivisiksi Cryptosporidium spp: lle). ja neljä näytettä, jotka olivat negatiivisia Cryptosporidium spp: n osalta.). 18S rRNA-määrityksellä pystyttiin havaitsemaan kaikki kahdeksan Cryptosporidium spp. IPC: n TaqMan-määrityksen todettiin vahvistavan vain IPC: n plasmidi-DNA: ta. IPC-määrityksessä Ct-arvoksi saatiin 32-37, mikä osoitti jopa 5 Ct: n PCR-estoarvoa joillekin ulostenäytteille (32 oli odotettu Ct-arvo estottomille reaktioille).
nykyinen tekniikka eroaa perinteisesti käytetystä OTELÄÄKKEESTÄ siten, että käytetään yhtä fluoresenssilla merkittyä oligonukleotidianturia (FRET-TaqMan-koetin) kahden näytteenottimen (OTELUOTAIN) sijaan, jossa yksi anturi sisältää luovuttaja-fluoroforin ja toinen anturi acceptor-fluoroforin (13,14). FRET-TaqMan-koetin on merkitty 5′ – päähän kahdella luovuttajan (FAM) ja acceptorin (Cy5.5) fluoroforeilla ja 3′ – päähän BHQ-3-sammuttimella, kuten TaqMan-koettimella. Ainutlaatuinen näytteenottimen sitova alue valitaan erottumaan kohde-DNA: sta siten, että voidaan seurata kahta eri fluoresenssimittausta kahdella eri havaintokanavalla (530 nm F1: ssä ja 705 nm F3: ssa) samasta monistusreaktiosta ilman, että värikompensointiohjelmistoa tarvitaan. Kohde-DNA: lla ja IPC: llä oli samat primerin sitoutumiskohdat, mutta eri luotainjärjestys. Näin varmistetaan, että samojen alukkeiden käyttö molemmissa DNA-kohteissa minimoi alukkeiden ja dimeerien muodostumisen tai vuorovaikutuksen alukkeiden välillä. Kun Fam / Cy5.5-fluoriforit sijoitetaan tiiviisti 5′: n päähän, resonanssienergian siirto tapahtuu Cy5.5-fluoriforin fluoresenssiemissioiden kasvaessa. Cy5.5: n ei-fluoresenssisenseptorin BHQ3: n käyttö vähentää kuitenkin potentiaalista taustafluoresenssia, mikä johtaa suurempaan signaali-kohinasuhteeseen. Havaittiin, että 100 kopiota IPC: tä lisättiin reaktioon, joka sisälsi ∼100 kopiota genomi C: tä. parvum-DNA: sta saatiin samanlaiset Ct-arvot (Ct = 32), kun Cryptosporidium TaqMan-määritys tehtiin singleplex-määrityksenä ja duplex-määrityksenä IPC TaqMan-määrityksellä. Kryptosporidium-positiivisten DNA-näytteiden paneelissa IPC osoitti, että jotkin näytteet eivät sisältäneet PCR-estäjiä (perustuen odotettuihin Ct-arvoihin 32), mutta toisiin näytteisiin liittyi inhibitio enintään 5 Ct-arvoihin.
äskettäin kehitetty sisäinen PCR-positiivinen kontrolli osoittautui herkäksi ja spesifiseksi kahden kohteen samanaikaiseen havaitsemiseen samassa reaktiossa, koska IPC-ja 18S rRNA-kohdegeeni merkittiin Fam/Cy5.5-BHQ3-ja Fam / BHQ1-kohdegeenillä kaksivärisessä multiplex-PCR: ssä R. A. P. I. D-laitteen F1-ja F3-fluoresenssikanavien valvontaan. 5 ’Fam-Cy5. 5/3’ BHQ-3-merkityn koettimen käyttö toisena toimittajana on edullista, koska kahden koettimen päästömaksimet olivat hyvin toisistaan. FRET-TaqMan kolminkertainen merkitty koetin suunnittelu voisi olla sovelluksia kehittää edullinen, kertakäyttöinen ”lab-on-a-chip” laite optiikka koostuu yhdestä sininen LED heräte ja kaksi päästölähteitä 530 nm ja 705 nm, asianmukaiset Optiset suodattimet havaita FAM yksi kanava ja Cy5. 5 muut. Tämä yhdistelmä ei vaatisi kahta suuritehoista fluoresenssilähde-ja ilmaisinjärjestelmää.
kiitokset
kirjoittajat tunnustavat Mike Powersin DNA Sequencing and Genomic Core Facility-laitoksessa (University of Utah, Salt Lake City, UT, USA) ja Rachelle Mullerin Idaho Technology, Inc. keskustelua sisäisen positiivisen kontrollin kehittämisestä R. A. P. I. D-sykliä varten. Tätä julkaisua tuettiin osittain varoilla, jotka annettiin käyttöön Centers for Disease Control and Prevention-Keskuksen, koordinointitoimisto Terrorismivalmiuden ja hätäavun kautta. Kauppanimien ja kaupallisten lähteiden käyttö on vain tunnistamista varten, eikä se merkitse sitä, että Centers for Disease Control and Prevention tai Yhdysvaltain terveys-ja Ihmispalveluministeriö hyväksyisivät sen.
- 1. Hartman, L. J., S. R. Coyne ja syyttäjä Norwood. 2005. Uuden sisäisen positiivisen kontrollin kehittäminen Taqman – pohjaisia määrityksiä varten. Mol. Solu. Luotaimet 19: 51-59.Crossref, Medline, CAS, Google Scholar
- 2. Hoorfar, J., B. Malorny, A. Abdulmawjood, N. Cook, M. Wagner ja P. Fach. 2004. Practical considerations in design of internal amplification controls for diagnostic PCR assays. J. Clin. Mikrobiolia. 42:1863–1868.Crossref, Medline, CAS, Google Scholar
- 3. Betsou, F., K. Beaumont, J. M. Sueur ja J. Orfila. 2003. Construction and evaluation of internal control DNA for PCR amplification of Chlamydia trachomatis DNA from urine samples. J. Clin. Mikrobiolia. 41:1274–1276.Crossref, Medline, CAS, Google Scholar
- 4. Burggraf, S. ja B. Olgemoller. 2004. Yksinkertainen tekniikka reaaliaikaisten vahvistusmääritysten sisäiseen valvontaan. Clin. Kemiaa. 50:819–825.Crossref, Medline, CAS, Google Scholar
- 5. Drosten, C., M. Weber, E. Seifried ja W. K. Roth. 2000. Uuden PCR-määrityksen ja kilpailevan sisäisen kontrollisarjan arviointi verenluovuttajien seulontaa varten. Transfusion 40: 718-724.Crossref, Medline, CAS, Google Scholar
- 6. Gruber, F., F. G. Falkner, F. Dorner ja T. Hammerle. 2001. Viruksen DNA: n kvantitointi reaaliaikaisella PCR: llä käyttäen duplex-vahvistusta, sisäistä standardointia ja kaksiväristä fluoresenssitunnistusta. Appl. Environ. Mikrobiolia. 67:2837–2839.Crossref, Medline, CAS, Google Scholar
- 7. Rosenstraus, M., Z. Wang, S. Y. Chang, D. DeBonville ja J. P. Spadoro. 1998. Rutiinidiagnostisen PCR: n sisäinen valvonta: suunnittelu, ominaisuudet ja vaikutus kliiniseen suorituskykyyn. J. Clin. Mikrobiolia. 36:191–197.Medline, CAS, Google Scholar
- 8. Stocher, M., V. Leb ja J. Berg. 2003. Kätevä lähestymistapa useiden sisäisen valvonnan DNA: n tuottamiseen reaaliaikaisten PCR-määritysten paneelille. J. Virol. Menetelmät 108: 1-8.Crossref, Medline, CAS, Google Scholar
- 9. Zimmermann, K. ja J. W. Mannhalter. 1996. Kvantitatiivisen kilpailukykyisen PCR: n tekniset näkökohdat. BioTechniques 21: 268-279.Link, CAS, Google Scholar
- 10. Jothikumar, N., A. J. da Silva, I. Moura, Y. Qvarnstrom ja V. R. Hill. 2008. Cryptosporidium hominis-ja Cryptosporidium parvum-bakteerien osoittaminen ja erottelu kahdella TaqMan-määrityksellä. J. Med. Mikrobiolia. 57:1099–1105.Crossref, Medline, CAS, Google Scholar
- 11. Altschul, S. F., W. Gish, W. Miller, E. W. Myers ja D. J. Lipman. 1990. Paikallinen kohdistushakutyökalu. J. Mol. Biol. 215:403–410.Crossref, Medline, CAS, Google Scholar
- 12. Hill, V. R., A. M. Kahler, N. Jothikumar, T. B. Johnson, D. Hahn ja T. L. Cromeans. 2007. Multistate evaluation of an ultrasuodatus-based procedure for simultaneous recovery of entic microbes in 100 litran hanavesinäytteistä. Appl. Environ. Mikrobiolia. 73:4218–4225.Crossref, Medline, CAS, Google Scholar
- 13. Bernard, P. S., M. J. Lay ja C. T. Wittwer. 1998. Integroitu monistus ja c677t-pistemutaation havaitseminen metyleenitetrahydrofolaattireduktaasigeenissä fluoresenssin resonanssienergiansiirron ja koettimien sulamiskäyrien avulla. Anaali. Biochem. 255:101–107.Crossref, Medline, CAS, Google Scholar
- 14. Wittwer, C. T., M. G. Herrmann, A. A. Moss ja R. P. Rasmussen. 1997. Continuous fluorescence monitoring of rapid cycle DNA amplification. BioTechniques 22:130–138.Link, CAS, Google Scholar