Efecto de iones comunes
Ciencia > Química > Química física > Equilibrios iónicos > Efecto de iones comunes
En este artículo, estudiaremos el efecto de iones comunes y sus aplicaciones.
El fenómeno en el que el grado de disociación de cualquier electrolito débil se suprime mediante la adición de una pequeña cantidad de electrolito fuerte que contiene un ion común se denomina efecto de iones comunes.
Ejemplo – 1: (Disociación de un ácido débil)
La ionización del ácido acético electrolítico débil (CH3COOH)se suprime mediante la adición de acetato de sodio electrolítico fuerte (CH3COONa)que contiene iones de acetato común (CH3COO–)
Explicación:
Supongamos que se trata de un ácido acético electrolítico (CH3COOH) con agua. Se disocia y existe un equilibrio como sigue,
CH3COOH(aq) CH CH3COO–(aq) + H+(aq)
Aplicando la ley de acción masiva,
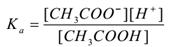
Donde ‘Ka’ es la constante de disociación del ácido.
Si se agrega una pequeña cantidad de un electrolito fuerte como el acetato de sodio (CH3COONa) a la solución acuosa de CH3COOH, se disocia y existe equilibrio, ya que
CH3COONa(aq) → CH3COO–(aq) + Na+(aq)
Aquí los iones CH3COO son comunes, por lo que su concentración aumenta. Según el principio de Le-Chatelier, el equilibrio se desplaza hacia la izquierda. Para mantener el valor de Ka constante, se aumenta la concentración de moléculas de CH3COOH. De esta manera, la ionización del CH3COOH se suprime añadiendo CH3COONa. Por lo tanto, el pH de la solución aumenta.
Ejemplo-2: (Disociación de una base débil):
La ionización de hidróxido de amonio electrolítico débil (NH4OH) se suprime añadiendo cloruro de amonio electrolítico fuerte (NH4Cl) que contiene ion de amonio común (NH4+)
Explicación:
Supongamos que un hidróxido de amonio electrolítico (NH4OH) se trata con agua. Se disocia y existe un equilibrio como sigue,
NH4OH(aq) NH NH4+(aq) + OH–(aq)
Aplicando la ley de acción masiva,
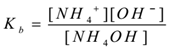
Donde ‘Kb’ es constante de disociación de la base.
Si se agrega una pequeña cantidad de un electrolito fuerte como el cloruro de amonio (NH4Cl) a la solución acuosa de NH4OH, se disocia y existe equilibrio, ya que
NH4Cl(aq) → NH4+(aq) + Cl–(aq)
Aquí los iones NH4+ son comunes, por lo que su concentración aumenta. Según el principio de Le-Chatelier, el equilibrio se desplaza hacia la izquierda. Para mantener constante el valor de Kb, se aumenta la concentración de moléculas de NH4OH. De esta manera, la ionización de NH4OH se suprime mediante la adición de NH4Cl. Por lo tanto, el pH de la solución disminuye.
Aplicaciones de Efecto Iónico Común:
Purificación de Sal Común:
Principio:
La adición de iones comunes a una solución saturada de sal causa la precipitación de sal. Cuando el producto iónico excede el producto de solubilidad, se produce precipitación.
Proceso y Explicación:
Se toma una solución saturada de sal común, libre de impurezas suspendidas y se pasa gas HCl a través de ella. En una solución saturada de INA impura, el equilibrio existe de la siguiente manera,
NaCl(aq) → Na+(aq) + Cl–(aq)
Si se pasa gas HCI puro a través de esta solución, siendo un electrolito fuerte, se disocia casi por completo y existe equilibrio,
HCl(aq) → H+(aq) + Cl–(aq)
Ahora Cl– es un ion común. La concentración de iones CI (iones comunes) aumenta. Según el principio de equilibrio de toLe-Chatelier, se desplaza hacia la izquierda. La disociación de InAI se suprime y la InAI pura se precipita como solidsalt. Por lo tanto, la INA pura puede precipitarse al pasar gas HCI en la solución saturada de INA impura.
Salazón de jabón:
Principio:
La adición de iones comunes a una solución saturada de sal causa la precipitación de sal. Cuando el producto iónico excede el producto de solubilidad, se produce precipitación.
Proceso y Explicación:
El jabón es sal sódica de ácidos grasos más altos (RCOONa). Se prepara por hidrólisis de aceites con NaOH. En la solución saturada de soap existe un equilibrio,
ROONa(aq) → RCOO–(aq) + Na+(aq)
Si se agrega una pequeña cantidad de NaCl a la solución de jabón saturada, se disocia como
NaCl(aq) → Na+(aq) + Cl–(aq)
Aumenta la concentración de iones Na+ (ion común). Debido al efecto común de iones, la disociación del jabón disminuye y el jabón se precipita y luego se puede eliminar fácilmente de la solución de jabón. Este proceso de obtener jabón sólido de una solución de jabón, mediante la adición de sal como NaCI, se denomina salazón del jabón.