Ved hjælp af en intern positiv kontrol
introduktion
real-time PCR muliggør kontinuerlig overvågning af fluoroforfluorescens under dannelsen af PCR-produkter i et lukket rørformat. I øjeblikket anvender tilgængelige metoder enten mærkede prober eller DNA-interkalerende farvestof til at overvåge amplifikationen af PCR-produkt. Det er et enkeltstrenget oligonukleotid, der indeholder en fluorofor og slukker placeret 10-30 baser fra hinanden. Det er en af de mest almindelige årsager til, at der er en stigning i fluoroforen, og at der er en stigning i fluorescens, hvilket resulterer i en stigning i fluoroforen. PCR-instrumenter i realtid er udstyret med fluorescensdetektorer og programmer, der er i stand til at estimere cyklustærsklen (Ct), den cyklus, hvor fluorescens er større end baggrundsfluorescens, til positive reaktioner. Teknikken kan imidlertid ikke differentiere et ægte negativt resultat fra et falsk negativt, når PCR påvirkes af amplifikationshæmmere. Efter nukleinsyreekstraktion rapporteres det, at hæmmere stadig kan være til stede fra kliniske prøver (f.eks. hæmoglobin), miljøprøver (f. eks. humic-og fulvinsyrer) og kemikalier anvendt under nukleinsyreekstraktion (f. eks. ethanol, vaskemidler eller chaotrope midler). Pålideligheden af diagnostiske assays øges ved inklusion af en intern kontrol nukleinsyre, der kan indikere tilstedeværelsen og virkningen af PCR-hæmmere (1,2). En intern positiv kontrol (IPC) forstærkes samtidigt i nærvær af en målsekvens ved anvendelse af en mærket fluorofor, der udsender lys ved en anden bølgelængde end fluoroforen, der anvendes til målsekvensanalysen, med de to fluoroforer detekteret i forskellige kanaler af realtids-PCR-instrumentet. Den almindeligt anvendte interne kontrol til PCR er et plasmid, der indeholder en sekvens, der ligner den for analysemålet bortset fra sondeområde. Et begrænset antal IPC-molekyler tilsættes til individuelt analysemål og co-amplificeres med målnukleinsyren; således er et positivt IPC-signal bevis for, at amplifikationsreaktionen forløb tilstrækkeligt til at generere et positivt signal fra meget små mængder målnukleinsyre. Denne funktion er vigtig for at sikre ækvivalent amplifikation af IPC og målnukleinsyren (3-9). Nogle enheder—såsom LightCycler 1.2 og LightCycler 2 (Roche Applied Science, Indianapolis, IN, USA), den robuste avancerede Patogenidentifikationsenhed (R. A. P. I. D.) instrument (Idaho Technology, Salt Lake City, UT, USA) og håndholdte PCR-instrumenter i realtid—er kun udstyret med en lyskilde og tilhørende emissionskanal. Multipleksering på disse typer instrumenter kræver anvendelse af multimærkede oligonukleotider og fluorescensresonansenergioverførsel (FRET) koncept. Imidlertid kan FRET-prober være udfordrende at designe og kan mangle robusthed i hypervariable regioner, og når ikke-optimale forstærkningsbetingelser er til stede. Brug af FRET-prober kræver identifikation af to regioner for to prober. FRET-sondesystemet er afhængig af tilstødende hybridisering af oligonukleotider af de to enkeltmærkede prober på en sådan måde detekteres fluorescensen af acceptorfarvestoffet gennem eksitationen af fluoroforen, der er bundet til den anden probe. En væsentlig ulempe ved FRET-sonden er kravet om et større sekvensområde, der er nødvendigt for at rumme to tilstødende sonder med et mellemrum på 2-5 nukleotider. Der er mulighed for multipleksering med andre etiketsystemer, såsom MegaStokes dye (Dyomics, Jena, Tyskland) og Pulsar 650 (Biosearch Technologies, Inc., Novato, CA, USA), men disse mærkningssystemer kræver spektralinformation for at kompensere for kanalkrosstalk og er ikke bredt tilgængelige. Denne undersøgelse kræver dog ikke farvekompensationsprogrammer og bruger fluoroforer (FAM, Cy5.5), der er bredt tilgængelige. Denne rapport fokuserer på designet af en tredobbelt mærket sonde for at muliggøre multipleksering i instrumenter udstyret med kun en blå lysemitterende diode (LED) eksitationskilde (470 nm) og tilhørende tre tilsvarende detektionskanaler (f.eks. 530 nm, 640 nm og 705 nm).
materialer og metoder
probedesign princip
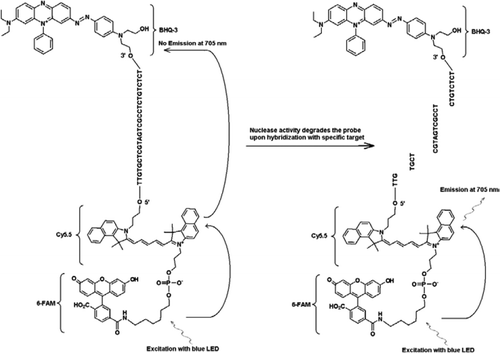
alle eksperimenter blev udført på Idaho Technology ‘ s R. A. P. I. D. system, et 32-prøve bærbart realtids PCR-instrument udstyret med en blå LED til ophidselse (470 nm) og tilhørende tre fluorescensdetekteringskanaler, der måler fluorescens ved 530, 640 og 705 nm til mono-og dobbeltfarveanalyser. Primere JVAF og JVAR (10) og probe 5’-FAM/BHK-1 blev syntetiseret ved CDC Biotechnology Core Facility (Atlanta, GA, USA) og probe 5 ‘FAM-Cy5.5/3′ BHK-3 blev syntetiseret ved Idaho Technology. For at muliggøre DUPLEKSMAN PCR blev en sonde mærket med 5’-FAM/BHK-1 (520 nm fluorescensbølgelængde) og en anden med 5 ‘FAM-Cy5.5/3’ BHK-3 (705 nm fluorescensbølgelængde). I opløsning forbliver sonden mærket med 5 ‘FAM-Cy5.5/3’ BH-3 slukket ved hybridisering til en sekvens, og ved efterfølgende spaltning af sonden ved hjælp af primerforlængelse elimineres slukeren. Dette resulterer i ærgre sig gennem ophidselse af FAM af lyskilden til R. A. P. I. D. instrument. Eksitationsenergien overføres til acceptorfluorophoren, Cy5.5, og den udsendte fluorescens måles i en anden fluorescenskanal (fluorescenskanal F3 for R. A. P. I. D. instrumentet). Udledningen af CY5.5 fluorescens er resultatet af kombinationen af FRET og Takman probeteknikker, så disse triple-mærkede prober kan betegnes som “FRET-Takman” prober.
primere, prober og plasmid
for at demonstrere multiplikationsfunktionerne i FRET-Takman-designet brugte vi en genusspecifik Cryptosporidium realtids PCR-analyse til at forstærke en 159-bp-del af 18S rRNA-genet (10). Den forreste primer (JVAF) var 5′-ATGACGGTAACGGGAAT-3′, omvendt primer (JVAR) var 5′-CCAATTACAAAAC-CAAAAAGTCC-3′, og Takman probe (JVAP) var 5′-FAM-CGCGCCTGCT-GCCTTCCTTAGATG-BHK1–3′, svarende til nukleotider 100-118, 258-236, og 184-161, henholdsvis af genbank tiltrædelse nr. AY458612. Primere til konstruktion af Cryptosporidium IPC indeholdt det samme sæt primersekvenser rapporteret til amplifikation af Cryptosporidium spp., bortset fra det probebindende område af mål-DNA’et, som blev erstattet med den kunstige sekvens 5′-TTGTGCTCGTAGTCGCCTCTGTCTCT-3 ‘ (JPIPC). Denne sondesekvens havde en udglødningstemperatur på 69 liter C og var designet til ikke at have nogen sekundær struktur. Teoretisk specificitet for intern probe blev konstateret ved en BLAST (11) søgning af sonden og primersekvenserne, hvor der ikke blev fundet nogen nøjagtig match med nogen Cryptosporidiumsekvens. IPC-fragmentet blev syntetiseret og klonet til et plasmid ved hjælp af integrerede DNA-teknologier (Coralville, IA, USA). En kendt koncentration af plasmid-DNA (100 kopier/reaktion) blev tilsat til masterblandingen af alle reaktioner undtagen i negativ kontrol. En tredobbelt mærket sonde (JPIPC), der er specifik for IPC, blev syntetiseret af Idaho-teknologi, som vist i Figur 1. FAM / Cy5. 5 / BHK3 oligo-nukleotid-sonden blev syntetiseret startende på 3’-enden med ikke-fluorescerende Sort Hulslukker (BHK-3) kontrolleret poreglas (CPG). 5 ‘- enden blev derefter konjugeret med en Cy5.5 phosporamidit efterfulgt af en terminal 5’ fluorescein (6-FAM) phosporamidit.
realtids PCR-analyse
Strømningscytometri sorteret Cryptosporidium parvum oocyster (200 oocyster pr.rør) opnået fra University of Viconsin ‘ S State Laboratory of Hygiene (Madison, Vi, USA). DNA fra C. parvum oocyster blev ekstraheret under anvendelse af en protokol beskrevet af Hill et al. (12) og suspenderet i 80 liter Tris EDTA (TE, pH 8,0) buffer. Reaktion, hvilket svarede til 5 oocyster (svarende til 100 kopier af mål-DNA). Denne blanding består af en blanding, der består af en blanding, der er beregnet til at fungere som en del af den. 204354, JVAF, jvar primere (0,4 liter hver), jvap probe (0,2 liter), JPIPC probe (0,2 liter) og 100 kopier af IPC. En alikvot (2 liter) af den ekstraherede DNA-prøve blev sat til reaktionskapillæren (Roche Diagnostics, Indianapolis, IN, USA) indeholdende 18 liter-reaktionsblanding. En C. parvum genomisk DNA-positiv kontrol (figur 2, plot 1), plasmidet IPC (figur 2, plot 2), en blanding af C. parvum positiv kontrol og IPC (figur 2, plot 3) og en no-skabelon kontrol (NTC) bestående af nuklease-frit vand (Cat. ingen. AM9932; Ambion, Foster City, CA, USA) i stedet for DNA ‘ et (Figur 2, plot 4) blev inkluderet i hvert eksperiment. Protokollen tog 30 minutter til at fuldføre med følgende PCR-betingelser: hot-start denatureringstrin ved 95 liter C i 3 minutter efterfulgt af 45 cyklusser med en 95 liter C denaturering i 5 sekunder, 60 liter C annealing i 30 sekunder med enkelt fluorescensopsamling (med en temperaturrampehastighed på 20 liter C/s). Et positivt resultat blev registreret for FAM i kanal F1 (530 nm) og for Cy5.5 i kanal F3 (705 nm). Amplifikationsreaktioner blev udført i tre eksemplarer. Amplikoner (159 bp) blev visualiseret ved agarosegelelektroforese og Glødgrøn nukleinsyrefarvning (een, Gaithersburg, MD, USA) for at bekræfte specificiteten af PCR-produktet.
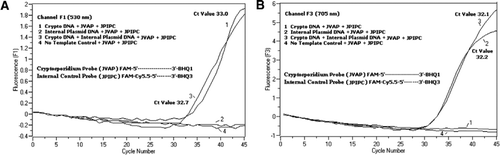
en ækvimolær blanding af en FAM/BHK1 og en FAM/Cy5.5/BHK3 blev tilsat i alle PCR-reaktionsblandinger. (A) kanal F1 monitorer stigning i FAM fluorescens for tilstedeværelsen af C. parvum. Plot 1 (kanal F1 indsamler primært FAM-signal), der kun indeholder C. parvum DNA afslørede kryptosporidium-specifikt FAM-signal i PCR. Plot 2 indeholdt kun plasmid-DNA og intet FAM-signal fra FAM/Cy5.5/BHK3-sonden. Plot 3 indeholdt begge C. parvum og plasmid DNA, men producerede kun C. parvum-specifikt FAM-signal. Plot 4 var en negativ prøve, der kun indeholdt nuklease-frit vand i stedet for ethvert skabelon-DNA; ingen fluorescens blev observeret fra proberne. (B) kanal F3 monitorer stigning i Cy5.5 for tilstedeværelsen af intern kontrol plasmid DNA. Plot 1 indeholdt kun C. parvum DNA og ingen fluorescens signal fra FAM/ BHK1 sonde. Plot 2 (kanal F3 indsamler primært Cy5.5–signal), der kun indeholder plasmid-DNA afsløret intern plasmidkontrol (IPC) – specifikt Cy5.5-signal i PCR. Plot 3 indeholdt begge C. parvum og plasmid DNA, men producerede kun IPC-specifikt Cy5. 5-signal. Plot 4 var en negativ prøve, der kun indeholdt nuklease-frit vand i stedet for ethvert skabelon-DNA; der blev ikke observeret fluorescens fra proberne.
resultater og diskussion
realtids PCR fluorescens signaler, der afspejler amplifikation af C. parvum genomisk DNA blev detekteret i F1-kanalen (figur 2A) på grund af FAM-mærkning af Takman-sonden. Fluorescens signal reflekterende amplifikation af IPC blev detekteret i F3-kanalen (figur 2b) på grund af FAM/Cy5.5 mærkning af IPC Takman sonden. Denne sonde frembragte en stigning i Cy5.5 i F3-kanalen (Cy5.5), men ingen stigning i FAM i F1-kanalen (FAM), når BHK3 adskilles fra FAM/Cy5.5 på grund af nuklease-aktivitet, fordi energi blev overført fra FAM til Cy5.5. Tilsvarende blev C. parvum genomisk DNA-amplifikation i dupleksreaktionen detekteret i F1-kanalen, mens IPC-amplifikationen samtidig blev detekteret i F3-kanalen. FAM har en spænding ved 495 nm og en emission ved 520 nm. Cy5. 5 har en spænding på 690 nm og en emission på 705 nm. Med så tæt nærhed mellem Cy5.5 og FAM på den tredobbelte mærkede IPC-sonde udsender CY5.5-fluoroforen fluorescens på grund af den komplette overførsel af energi fra FAM-fluoroforen, hvilket resulterer i ingen fluorescensemission af FAM i F1-kanalen (figur 2a). Negative kontrolreaktioner viste ikke en stigning i fluorescens på grund af FAM eller Cy5.5. Disse resultater viser også, at en enkelt blå (470 nm) LED-kilde er tilstrækkelig til at overvåge dobbelt fluorescensemissioner gennem F1 (530 nm) og F3 (705 nm) kanaler uden nogen spektral overlapning i de respektive overvågningskanaler for FAM og Cy5.5. FRET-Takman-teknikken blev også testet ved hjælp af et panel på 12 DNA-ekstrakter fra afføringsprøver (8 fra prøver, der tidligere var bestemt til at være positive for Cryptosporidium spp. og fire prøver, der var negative for Cryptosporidium spp.). 18S rRNA-analysen var i stand til at detektere alle otte Cryptosporidium spp. IPC-analysen viste sig kun at forstærke IPC-plasmid-DNA ‘ et. IPC-analysen resulterede i Ct-værdier på 32-37, hvilket indikerede op til 5 Ct-værdier for PCR-hæmning for nogle afføringsprøver (32 var den forventede Ct-værdi for reaktioner uden hæmning).
den foreliggende teknik adskiller sig fra traditionelt anvendt FRET ved, at der anvendes en fluorescerende mærket oligonukleotidprobe i stedet for to prober (FRET-prober), hvor den ene sonde indeholder donorfluoroforen, og den anden sonde indeholder acceptorfluoroforen (13,14). Ved 5′-enden er mærket med to fluoroforer af donor (FAM) og acceptor (Cy5.5) fluoroforer og ved 3′-enden med en BHK-3-slukker som en Takman-sonde. Den unikke probebindende region er valgt til at differentiere fra mål-DNA ‘ et for at overvåge to forskellige fluorescensmålinger i to forskellige detektionskanaler (530 nm i F1 og 705 nm i F3) fra den samme amplifikationsreaktion uden behov for at inkludere farvekompensationsprogrammer. Mål-DNA og IPC havde de samme primerbindingssteder, men en anden sondesekvens. Dette sikrer, at brugen af de samme primere til begge DNA-mål for at minimere dannelse af primer-dimer eller interaktion mellem primersæt. Når FAM / Cy5.5 fluoroforer placeres tæt ved 5’ – enden, finder resonansenergioverførsel sted med en stigning i fluorescensemission af Cy5.5 fluoroforen. Imidlertid reducerer brugen af BHK3, en ikke-fluorescensacceptor for Cy5.5, potentiel baggrundsfluorescens, hvilket resulterer i et højere signal / støjforhold. Det blev fundet, at tilsætning af 100 kopier af IPC til en reaktion indeholdende 100 kopier af genomisk C. parvum DNA resulterede i lignende Ct-værdier (Ct = 32), når Cryptosporidium Takman assay blev udført som en enkeltpleks assay og som en dupleks assay med IPC Takman assay. Når det blev anvendt på et panel af Cryptosporidium-positive DNA-prøver, indikerede IPC, at nogle prøver ikke indeholdt PCR-hæmmere (baseret på forventede Ct-værdier på 32), men andre prøver var forbundet med inhibering af op til 5 Ct-værdier.
den nyudviklede interne PCR-positive kontrol viste sig at være følsom og specifik til samtidig påvisning af to mål i den samme reaktion på grund af mærkning med FAM/Cy5.5-BHK3 og FAM / BHK1 for det respektive IPC-og 18S rRNA-målgen i en dobbeltfarvet multipleks PCR til overvågning i F1-og F3-fluorescenskanaler i R. A. P. I. D-instrumentet. Anvendelsen af den 5 ‘FAM-Cy5.5/3’ 3-mærkede sonde som den anden reporter er fordelagtig, fordi emissionsmaksiumet for de to prober var godt adskilt fra hinanden. Triple-mærket probedesign kunne have applikationer til at udvikle en billig, engangs” lab-on-a-chip ” – enhed med optik bestående af en blå LED-spænding og to emissionskilder på 530 nm og 705 nm med passende optiske filtre til at detektere FAM i den ene kanal og Cy5.5 i den anden. Denne kombination ville ikke kræve to kraftige fluorescenskilde-og detektionssystemer.
anerkendelser
forfatterne anerkender hjælp fra Mike-beføjelser ved DNA-sekventering og genomisk Kernefacilitet (University of Utah, Salt Lake City, UT, USA) og Rachelle Muller ved Idaho Technology, Inc. til diskussion om udviklingen af den interne positive kontrol for R. A. P. I. D cycler. Denne publikation blev delvist støttet af midler stillet til rådighed gennem Centers for Disease Control and Prevention, koordinerende kontor for Terrorberedskab og beredskab. Brug af handelsnavne og kommercielle kilder er kun til identifikation og indebærer ikke godkendelse fra Centers for Disease Control and Prevention eller US Department of Health and Human Services.
- 1. Hartman, L. J., S. R. Coyne og D. A. Norved. 2005. Udvikling af en ny intern positiv kontrol for Takman-baserede analyser. Mol. Celle. Sonder 19: 51-59.Crossref, Medline, CAS, Google Scholar
- 2. Han er en af de mest kendte og mest kendte mennesker i verden. 2004. Praktiske overvejelser i design af interne forstærkningskontroller til diagnostiske PCR-assays. J. Clin. Mikrobiol. 42:1863–1868.Crossref, Medline, CAS, Google Scholar
- 3. Betsou, F., K. Beaumont, J. M. Sueurog J. Orfila. 2003. Konstruktion og evaluering af intern kontrol-DNA til PCR-amplifikation af Chlamydia trachomatis DNA fra urinprøver. J. Clin. Mikrobiol. 41:1274–1276.Crossref, Medline, CAS, Google Scholar
- 4. Burggraf, S. Og B. Olgemoller. 2004. Enkel teknik til intern kontrol af realtidsforstærkningsanalyser. Clin. Chem. 50:819–825.Crossref, Medline, CAS, Google Scholar
- 5. Han er en af de mest kendte i verden. 2000. Evaluering af en ny PCR-analyse med konkurrencedygtig intern kontrolsekvens til bloddonorscreening. Transfusion 40: 718-724.Crossref, Medline, CAS, Google Scholar
- 6. Gruber, F., F. G. Falkner, F. Dorner og T. Hammerle. 2001. Kvantificering af viralt DNA ved PCR i realtid ved anvendelse af dupleksforstærkning, intern standardisering og tofarvet fluorescensdetektion. Appl. Environ. Mikrobiol. 67:2837–2839.Crossref, Medline, CAS, Google Scholar
- 7. Rosenstraus, M., M. S. Y. Chang, D. DeBonville og J. P. Spadoro. 1998. En intern kontrol til rutinemæssig diagnostisk PCR: design, egenskaber og effekt på klinisk ydeevne. J. Clin. Mikrobiol. 36:191–197.Medline, CAS, Google Scholar
- 8. Stocher, M., V. Leb og J. Berg. 2003. En bekvem tilgang til generering af flere interne kontrol DNA til et panel af real-time PCR assays. J. Virol. Metoder 108: 1-8.Crossref, Medline, CAS, Google Scholar
- 9. K. og J. H. Mannhalter. 1996. Tekniske aspekter af kvantitativ konkurrencedygtig PCR. Bioteknologi 21: 268-279.Link, CAS, Google Scholar
- 10. Jothikumar, N., A. J. da Silva, I. Moura, Y. Kvarnstrom og V. R. Hill. 2008. Detektion og differentiering af Cryptosporidium hominis og Cryptosporidium parvum ved hjælp af to Takman-analyser. J. Med. Mikrobiol. 57:1099–1105.Crossref, Medline, CAS, Google Scholar
- 11. Han er en af de mest kendte og mest kendte mennesker i verden. 1990. Grundlæggende lokal tilpasning søgeværktøj. J. Mol. Biol. 215:403–410.Crossref, Medline, CAS, Google Scholar
- 12. Hill, V. R., A. M. Kahler, N. Jothikumar, T. B. Johnson, D. Hahnog T. L. Cromeans. 2007. Multistate evaluering af en ultrafiltreringsbaseret procedure til samtidig genopretning af enteriske mikrober i 100-liters ledningsvandsprøver. Appl. Environ. Mikrobiol. 73:4218–4225.Crossref, Medline, CAS, Google Scholar
- 13. Bernard, P. S., M. J. Lay og C. T. klovn. 1998. Integreret amplifikation og påvisning af C677T-punktmutationen i methylentrahydrofolatreduktasegenet ved fluorescensresonansenergioverførsel og sondesmeltekurver. Anal. Biochem. 255:101–107.Crossref, Medline, CAS, Google Scholar
- 14. C. T., M. G. Herrmann, A. A. Moss og R. P. Rasmussen. 1997. Continuous fluorescence monitoring of rapid cycle DNA amplification. BioTechniques 22:130–138.Link, CAS, Google Scholar