Kemi lærende
Hvad er en koordinere kovalent binding?
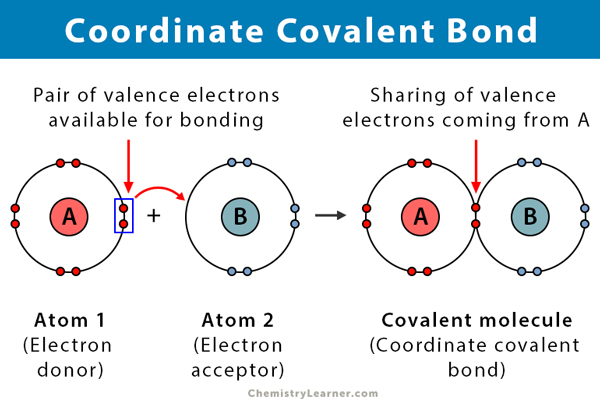
en kovalent binding dannes, når to atomer deler elektroner. En koordinatkovalent binding, også kendt som en dativ kovalent binding, er en type kovalent binding, hvor det delte par elektroner kommer fra et af atomerne. Atomerne holdes sammen, fordi begge kerner tiltrækker elektronparet. Når den kovalente binding er dannet, er det umuligt at skelne elektronernes Oprindelse. Denne form for binding observeres typisk ved binding af metalioner til ligander. Ikke-metaller kan dog også deltage i denne binding. Reaktionen mellem Levi syre og base er en koordinat kovalent binding .
en kompleks ion er lavet af to ting, en metalion og forbindelser kaldet ligander. Ligander er neutrale molekyler eller ioner, der indeholder ensomme elektronpar, der kan binde sig til metalionen. Almindelige ligander er ammoniak (NH3), vand (H2O) og halogenidioner (Cl–, Br–). Ligander betragtes som uvis baser, fordi de deler deres elektronpar med metalionen. Metalioner er altid positive, så de er ret attraktive for ensomme par elektroner.
fakta og egenskaber ved koordinat kovalent binding
koordinat kovalent binding har mange egenskaber, der er nødvendige for at opnå en ligheder med kovalent binding. Her er nogle af dens egenskaber:
- finder sted mellem en elektrondonor og en elektronacceptor, typisk mellem et metal og en ligand
- finder sted mellem forskellige atomer
- dannet ved deling af elektroner doneret af et af atomerne
- stiv og retningsbestemt
- Polar
- atomer følger oktetreglen
- atomet, der donerer elektronerne, kaldes en donor, og atomet, der accepterer dem, kaldes en acceptor.
- forbindelser er sparsomt opløselige i vand
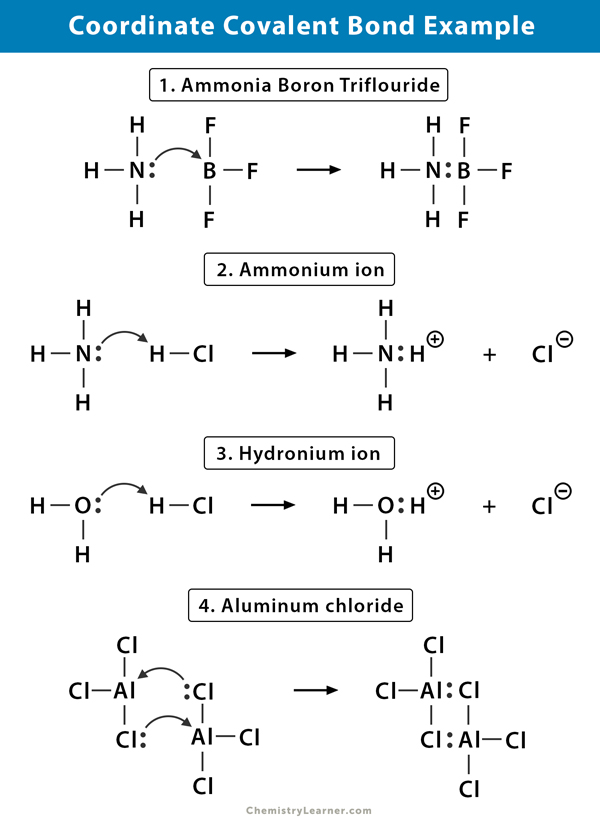
eksempler på Koordinatkovalent binding
Her er nogle eksempler på molekyler, hvor der findes koordinatkovalent binding .
Ammonium (NH4+) ion
ammoniumionen dannes ud fra reaktionen af ammoniak (NH3) gas med hydrogenchlorid (HCl) gas. I NH4 + er det fjerde hydrogen bundet af en koordinatkovalent binding, fordi kun hydrogenens kerne overføres fra chloren til nitrogenet. Hydrogenens elektron efterlades på kloren for at danne en negativ chlorid (Cl–) ion.
Ammoniakbortrifluorid (NH3.BF3)
bortrifluorid (BF3) er en forbindelse, der ikke har en ædelgasstruktur omkring bor (B) – atomet. Boret har kun tre par elektroner i sin valanceskal og kræver et par for at fuldføre orbitalen. Derfor er BF3 elektronmangel. Det ensomme par på nitrogen (N) i ammoniak (NH3) molekylet bruges til at overvinde denne mangel, og en kompleks forbindelse dannes gennem en koordinatkovalent binding.
Hydroniumion (H3O+)
når hydrogenchlorid (HCI) gas opløses i vand for at gøre saltsyre (HCI AK.), dannes en koordinatkovalent binding i hydronionionen. Hydrogenkernen (H) overføres til vandmolekylet (H2O), som har et ensomt par elektroner til dannelse af hydronium. Så h bidrager ikke med nogen elektroner til bindingen.
aluminiumchlorid (Al2Cl6)
bindingen i aluminiumchlorid (AlCl3) er i det væsentlige kovalent. Hvert aluminium (Al) atom har et underskud på to elektroner i sin valance shell, og chlor (Cl) har et ensomt par. Al danner en koordinatkovalent binding med Cl-atomet på en tilstødende alcl3-gruppe. Da hvert af to Al-atomer gør dette, er aluminiumchlorid et kovalent dimermolekyle med formlen Al2Cl6.
kulilte (CO)
kulstof (C) har fire elektroner i sin valensskal, og ilt (O) har seks. Både kulstof og ilt deler deres to elektroner. Mens oktetreglen er tilfreds med ilt, er der stadig et underskud på to elektroner på kulstof. Så ilt deler sine to elektroner med kulstof for at danne en koordinatkovalent binding ud over de to regelmæssige (dobbelt) kovalente bindinger.