basicitet af aminer og pKaH
kvantificering af basiciteten af aminer ved hjælp af “PKA af Konjugatsyren”, aka “pKaH”
hvordan måler du basiciteten af en amin? Eksempel: Hvad er en stærkere base: pyridin eller piperidin?
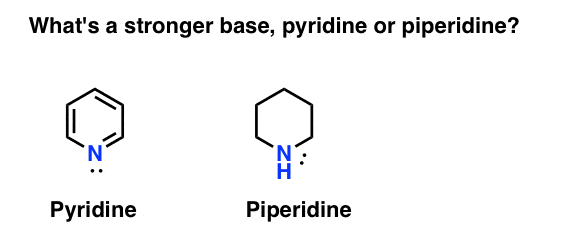
Hvis du sagde piperidin, tillykke – det er faktisk en stærkere base.
men hvorfor? Og hvor meget stærkere? Hvordan kan man gå om at forsøge at besvare disse spørgsmål? Når alt kommer til alt kan vi let sammenligne styrken af syrer ved at undersøge deres pKa ‘ er. skal vi ikke være i stand til at gøre det samme med baser?
Ja, på en måde. Her er to nøglepunkter for i dag:
- den bedste måde at kvantificere basiciteten af en amin er at undersøge pKa af dens konjugatsyre.
- jo højere PKA af konjugatsyren er, desto stærkere er basen.
i dette indlæg viser vi nogle specifikke eksempler på, hvordan man bruger pKa-værdier til at sammenligne aminernes basicitet.
i et efterfølgende indlæg vil vi derefter undersøge nogle nøgletendenser, der ligger til grund for aminernes basicitet.
Indholdsfortegnelse
- hurtig gennemgang: Syrer, Baser, konjugerede syrer og konjugerede baser
- brug af pKa til at måle surhedsgrad
- brug af pKa til at kvantificere basiciteten af aminer
- “PKA af Konjugatsyren” kan forkortes som “pKaH”
- brug af pKaH til at bestemme de Relative Basiciteter af aminer
- nogle ord med forsigtighed på pKa-værdier for aminer
- hvilke nøglefaktorer styrer Aminernes basicitet?
- noter
1. Hurtig Gennemgang: Syrer, baser, konjugerede syrer og konjugerede baser
lad os først hurtigt gennemgå nogle basicity basics.
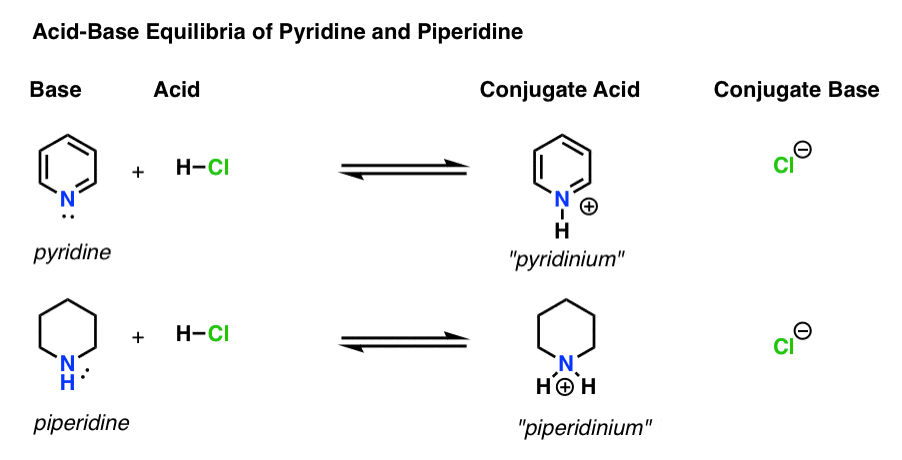
Der er fire aktører i hver syre-base reaktion.
- basen er den art, der donerer et ensomt par til H+ (også kendt som en “proton” eller “hydrogenkerne”). Pyridin nedenfor)
- konjugatsyren er den art , der resulterer, efter at basen danner en binding til H (f .eks. “pyridinium”, som har en ny N–h-binding)
- syren er den art, der mister H+. Det er her bindingen til H bryder (f. eks. H-Cl)
- den konjugerede base er den art, der er tilbage, efter at syren donerer H+ til basen (f.eks. Ved at følge de obligationer, der dannes og brydes, kan du identificere hver skuespiller.
2. Brug af pKa til at måle surhedsgrad
hver syre-base-reaktion kan skrives som en ligevægt mellem en fremad og omvendt reaktion. Vi har set, at surhedskonstanten, Ka, er et mål for, hvor let en art dissocierer for at give H+ og den konjugerede base.
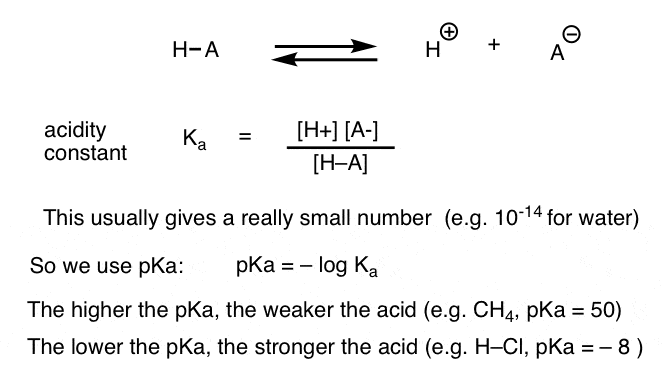
for nemheds skyld bruger vi den negative log af Ka, kaldet pKa, som ligner den velkendte pH-skala, men kan strække sig ud over 14, fordi den ikke er strengt begrænset til vandigt opløsningsmiddel. pKa-værdier spænder fra -10 eller deromkring for meget stærke syrer (f.eks. hydroiodinsyre, H–I) til 50 og derover for visse carbonhydrider (f. eks. Ethan).
hvordan kan vi anvende disse begreber til at måle basicitet? Kunne vi ikke skifte ting rundt og definere et udtryk, Kb, som er ligevægten for , hvor let en art kombinerer med H+, definerer pKb som sin negative log og sammenligner baser ved at se på deres pKb-værdier?
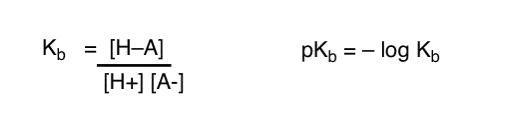
Ja…. det kunne vi. Det tror jeg. Hvis vi skulle. Men generelt er organiske kemikers mening om dette emne “skrue pKb”.
når alt kommer til alt er pKa-værdier målt for tusinder af organiske molekyler. Vil nogen virkelig også huske et stort sæt pKb-værdier? Fandeme Nej!
i stedet kan vi nemt bruge pKa-værdier som en indirekte måling af basicitet. Sådan gør du.
3. Brug af pKa-værdier til at kvantificere basicitet af aminer
husk disse to udødelige linjer af prosa, værd at recitere til dig selv om natten:
- jo stærkere syren er, jo svagere er konjugatbasen.
- jo svagere syren er, desto stærkere er konjugatbasen.
pKa for konjugatsyren af pyridin (“pyridinium”) er blevet målt. Det er omkring 5.2 .
Vi har også en værdi for pKa for konjugatsyren af piperidin. Det er omkring 11 .
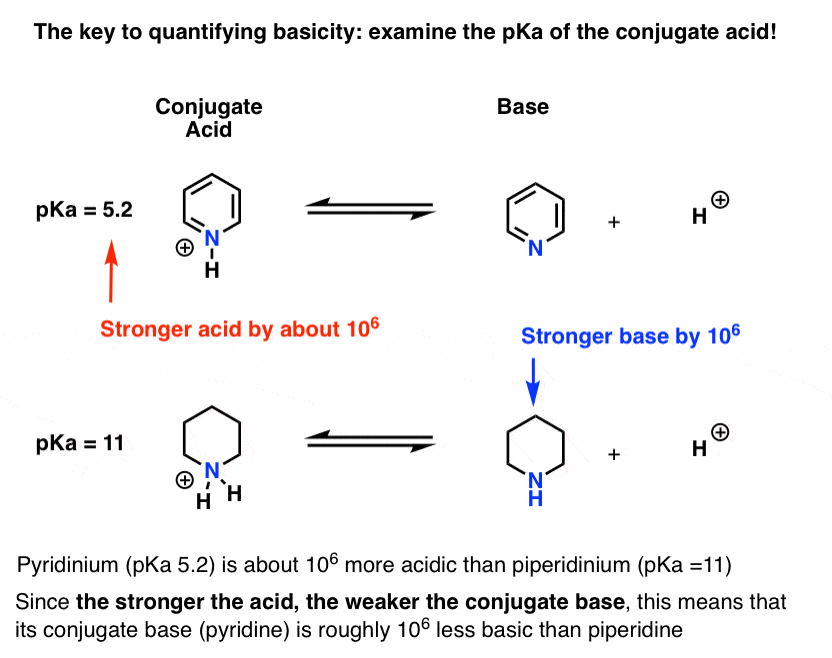
fra disse pKa-værdier kan vi fortælle, at konjugatsyren af pyridin er stærkere end konjugatsyren af piperidin med omkring 6 pKa-enheder. Da hver pKa-enhed repræsenterer en faktor på 10, er det en faktor på omkring 1 million.
da” jo stærkere syren er, jo svagere er konjugatbasen”, er pyridin derfor en svagere base end piperidin med en faktor på 1 million.
4. “PKA af Konjugatsyren “kan forkortes som”pKaH “
udtrykket” PKA af konjugatsyren ” er lidt af en mundfuld at bruge regelmæssigt. At være naturligt doven, vi vil gerne kondensere dette lidt til almindelig brug.
da konjugatsyren i en base (“B”) er “BH”, kan vi forkorte “pKa af konjugatsyren i en base” som dens pKaH.
Dette lader os sige, at pkah af pyridin er 5,2, og pkah af piperidin er 11.
Vi kan derefter grave i litteraturen for at finde andre baser at sammenligne det med.
for eksempel, præcis hvor grundlæggende er ammoniak (NH3) ? Konjugatsyren af ammoniak, NH4 (+), er 9,2 . Tilsvarende kan vi sige, at pkah af ammoniak er 9,2. Dette sætter det mellem pyridin og piperidin på basisskalaen.
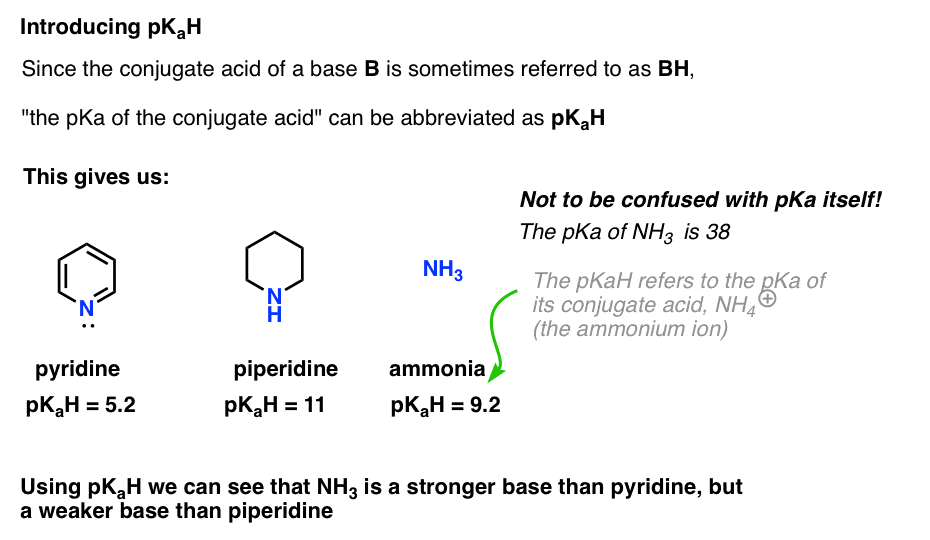
Bemærk, at det er meget vigtigt ikke at forveksle pKaH med pKa. Pkah af ammoniak er 9,2, som måler surheden af dens konjugatsyre, NH4(+).
PKA af ammoniak selv er 38, som måler ligevægtskonstanten for dissociation af NH3 for at give sin konjugerede base, NH2(-) og H+.
det betyder, at 38 er pkah af amidionen NH2 (–), som du måske har stødt på før som den stærke base (NaNH2), der bruges til at deprotonere terminale alkyner (pKa =25). Ved hjælp af pKaH kan vi bestemme, at NH2(–) handler om (38 – 9) = 29 størrelsesordener mere grundlæggende end NH3 !
5. Brug af pKaH til at bestemme de Relative Basiciteter af aminer
brug af pKaH til at bestemme basernes relative styrker er et ret nyttigt trick.
Her er nogle repræsentative eksempler på nitrogenholdige molekyler. Nedenfor er pKa af deres konjugerede syrer.
Hvad er den stærkeste base her? Hvad er den svageste?
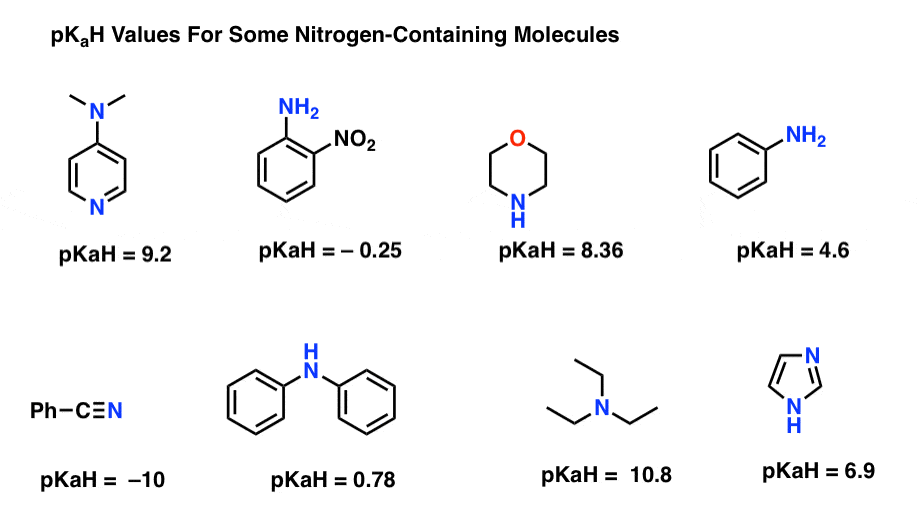
den laveste pKaH-værdi her er -10 for nitrilen (nederst til venstre). Dette betyder, at nitrilen er den mindst basale af alle disse molekyler.
den højeste pKaH-værdi her er 10,8 for triethylamin. Det gør triethylamin til den stærkeste base ud af alle de nævnte.
nogle forsigtighedsord på pKa-værdier for aminer
to ting at passe på, især når man læser andre online kilder om dette emne.
for det første rapporteres nogle gange pKaH-værdierne for aminer som pKa-værdier uden forklaring. De bedste PKA-borde gør det ikke, men det er svært at sortere hveden fra agnet, når du lige er startet.
Hvis du ser en unormalt lav pKa-værdi for en amin, henviser det sandsynligvis til pkah af konjugatsyren.
for eksempel er her et pKa-bord, hvor PKA af methylamin (CH3NH2) er opført som 10.63.
det er lavt. Forhåbentlig på dette tidspunkt bør en sådan værdi på 10 for en PKA af en amin slå dig som underlig, især da pKa af den nært beslægtede NH3 er 38.
værdien af 10,63 refererer faktisk til pKa af konjugatsyren af methylamin, ikke selve methylamin. Det er en pkah værdi.
tilsvarende viser den samme tabel trimethylamin som en pKa på 9,8 . Igen er dette faktisk dets pKaH. Jeg kan ikke finde en faktisk pKa–værdi for trimethylamin, men jeg vil gætte, at det er >40, da den konjugerede base af trimethylamin er carbanion (CH3)2n– CH2 ( -)).
en anden, mindre almindelig kilde til forvirring er, at pKaH af en amin undertiden rapporteres som dens pKb, såsom i denne tabel, der rapporterer pKb af NH3 som 9.2 . Dette er unøjagtigt.
igen kommer pKb-værdier ikke rigtig meget op i organisk kemi, selvom jeg får at vide, at de nogle gange optræder på DAT / MCAT.
7. Hvilke Nøglefaktorer Styrer Aminernes Basicitet?
nu hvor vi i det mindste har lært at kvantificere og fortolke PKA-værdierne af aminer og deres konjugerede syrer, kan vi begynde at stille det centrale spørgsmål: Hvorfor? Hvilke nøglefaktorer styrer aminernes basicitet? Hvad er de vigtige tendenser?
for eksempel, hvorfor er pyridin en svagere base end piperidin? Hvorfor er nitriler endnu svagere baser? Hvorfor har elektronudtrækningsgrupper tendens til at gøre aminer svagere baser?
den gode nyhed er, at hvis du allerede forstår de faktorer, der styrer surhedsgrad, skal du blot anvende de nøjagtige samme principper – men omvendt!
Vi dækker det i næste indlæg. Fem faktorer, der påvirker Aminernes basicitet
noter
fodnote 1. Der er mange syrer, der er ikke-baser (såsom NH4, der mangler et ensomt par) og mange baser, der er ikke-syrer, såsom Cl (–), som ikke er i stand til at acceptere et ensomt par. Derfor siger “jo stærkere syren er, jo svagere er basen” forkert.
fodnote 2. Det er den måling, der opnås ved hjælp af vand som opløsningsmiddel. Du kan se en anden værdi, 3.4, som opnås, når dimethylsulfoksid (DMSO) anvendes som opløsningsmiddel. Se PKA-tabeller (DMSO)