Společný Ion Efekt
Věda > Chemie > Fyzikální Chemie > Iontové Rovnováhy > Společný Ion Efekt
V tomto článku budeme studovat společné ion efekt a jeho aplikace.
jev, při kterém se stupeň disociace případných slabých elektrolytů je potlačena přidáním malého množství silných elektrolytů obsahující společný ion se nazývá společný ion efekt.
Příklad – 1: (Disociace z WeakAcid)
Ionizace slabé elektrolyty kyselina octová (CH3COOH)je potlačena přidáním silné elektrolyty octan sodný (CH3COONa)obsahující společné acetát ion (CH3COO–)
Vysvětlení:
Předpokládejme, elektrolyt kyselina octová (CH3COOH) istreated s vodou. To se odloučí a rovnovážné existsas takto,
CH3COOH(aq) ⇌CH3COO–(aq) + H+(aq)
použitím zákon masové akce,
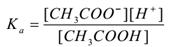
Kde Ka je disociační konstanta kyseliny.
Když se malé množství silného elektrolytu jako roztok octanu sodného (CH3COONa) je přidán do vodného roztoku CH3COOH, dostane disociované a rovnováha existuje,
CH3COONa(aq) → CH3COO–(aq) + Na+(aq)
CH3COO– iontů jsou časté, proto se jejich koncentrace zvyšuje. Podle le-Chatelierova principu se rovnováha posune doleva. Pro udržení konstantní hodnoty Ka se zvyšuje koncentrace molekul CH3COOH. Tímto způsobem je ionizace CH3COOH potlačena přidáním Ch3coony. Tím se zvyšuje pH roztoku.
Příklad – 2: (Disociace z WeakBase):
Ionizační slabý elektrolyt hydroxid Amonný (NH4OH)je potlačena přidáním silného elektrolytu chloridu Amonného (NH4Cl) containingcommon amonný ion (NH4+)
Vysvětlení:
Předpokládejme, elektrolyt hydroxid Amonný (NH4OH)se smísí s vodou. To se odloučí a rovnovážné existsas takto,
NH4OH(aq) ⇌ NH4+(aq) + OH–(aq)
použitím zákon masové akce,
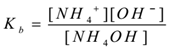
Kde Kb je disociační konstanta báze.
Když se malé množství silných elektrolytů jako je chlorid Amonný (NH4Cl) je přidán do vodného roztoku NH4OH, dostane disociované a rovnováha existuje,
NH4Cl(aq) → NH4+(aq) + Cl–(aq)
NH4+ ionty jsou časté, proto se jejich koncentrace zvyšuje. Podle le-Chatelierova principu se rovnováha posune doleva. Pro udržení hodnoty Kb konstantní se zvyšuje koncentrace molekul NH4OH. Tímto způsobem je ionizace NH4OH potlačena přidáním NH4Cl. Tím se pH roztoku snižuje.
aplikace společného iontového efektu:
Čištění kuchyňská Sůl:
Princip:
kromě běžných iontový nasycený roztok soli způsobuje vysrážení solí. Když iontový produkt překročí produkt rozpustnosti, dochází ke srážení.
procesa vysvětlení:
je odebrán nasycený roztok kuchyňské soli bez suspendovaných nečistot a prochází jím plyn HCl. V saturatedsolution nečistou Nadži, rovnováha existuje takto,
NaCl(aq) → Na+(aq) + Cl–(aq)
Pokud čisté HCL plyn je veden přes toto řešení, beingstrong elektrolyt, disociuje prakticky zcela a rovnováha existuje,
HCl(aq) → H+(aq) + Cl–(aq)
Cl– je společný ion. Koncentrace CI-iontů (běžných iontů) se zvyšuje. Podle chatelierova principu se rovnováha posouvá doleva. Disociace NaCI je potlačena a čistá NaCI je vysrážena jako pevná sůl. Čistý NaCI se tak může vysrážet průchodem plynu HCI v nenasyceném roztoku nečistého NaCI.
Solení z Mýdla:
Princip:
kromě běžných iontový nasycený roztok soli způsobuje vysrážení solí. Když iontový produkt překročí produkt rozpustnosti, dochází ke srážení.
procesa vysvětlení:
mýdlo je sodná sůl vyšších mastných kyselin (RCOONa). Připravuje se hydrolýzou olejů s NaOH. V saturatedsoap řešení existují v rovnováze,
ROONa(aq) → RCOO–(aq) + Na+(aq)
Když se malé množství NaCl je přidáván do nasyceného roztoku mýdla, je oddělena jako
NaCl(aq) → Na+(aq) + Cl–(aq)
Koncentrace Na+ iontů (společný ion) zvyšuje. Díky společnému iontovému účinku se disociace mýdla sníží a mýdlo se vysráží a poté může být snadno odstraněno z roztoku mýdla. Tento proces získávání pevného mýdla z mýdlového roztoku přidáním soli jako NaCI se nazývá solení z mýdla.