Chemistry Learner
co je to souřadnicová kovalentní vazba?
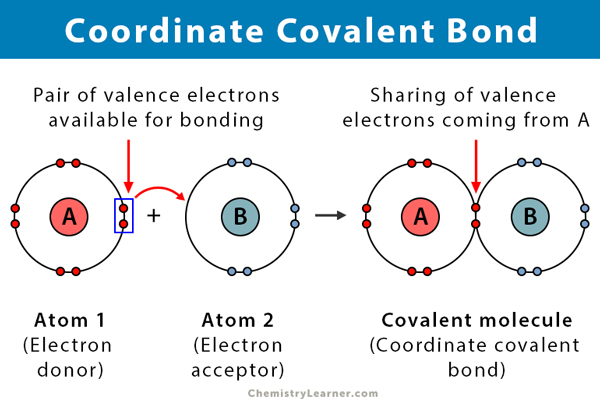
kovalentní vazba vzniká, když dva atomy sdílejí elektrony. Koordinovat kovalentní vazby, také známý jako dativ kovalentní vazba, je typ kovalentní vazby, v němž sdílený elektronový pár pochází od jednoho z atomů. Atomy jsou drženy pohromadě, protože obě jádra přitahují elektronový pár. Jakmile se vytvoří kovalentní vazba, není možné rozlišit původ elektronů. Tento druh vazby je obvykle pozorován při vazbě kovových iontů na ligandy. Na tomto lepení se však mohou podílet i nekovy. Reakce mezi Lewisovou kyselinou a bází je souřadnicová kovalentní vazba .
komplexní iont je tvořen dvěma věcmi, kovovým iontem a sloučeninami zvanými ligandy. Ligandy jsou neutrální molekuly nebo ionty obsahující osamělé elektronové páry, které se mohou spojit s kovovým iontem. Běžné ligandy jsou amoniak (NH3), voda (H2O) a halogenidové ionty (Cl–, Br -). Ligandy jsou považovány za Lewisovy báze, protože sdílejí své elektronové páry s kovovým iontem. Kovové ionty jsou vždy pozitivní, takže jsou docela atraktivní pro osamělé páry elektronů.
Fakta a Vlastnosti Koordinovat Kovalentní vazby
koordinovat kovalentní vazba má mnoho podobností se kovalentní vazba. Zde jsou některé z jeho vlastností:
- probíhá mezi elektron donorů a elektron akceptor, typicky mezi kovem a ligandem
- probíhá mezi odlišnými atomy
- Tvořena sdílení elektronů daroval jeden z atomů
- Pevná a směrové
- Polární
- Atomy sledovat octet pravidlo
- atom darovat elektrony, se nazývá dárce, a atom přijímá je, se nazývá akceptor.
- Sloučeniny jsou rozpustné ve vodě
Příklady Koordinovat Kovalentní vazby
Zde jsou některé příklady molekul, kde koordinovat kovalentní vazby existuje .
amonný (NH4+) ion
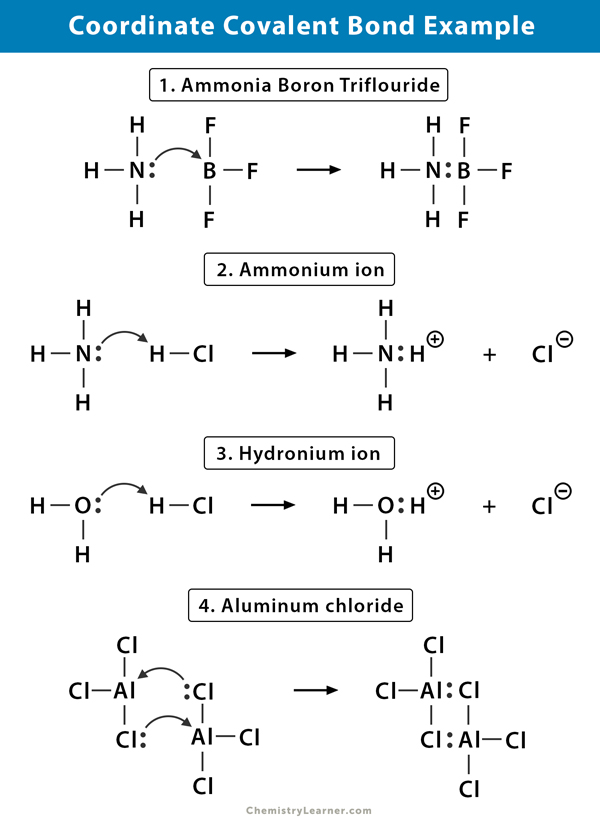
amonný iont vzniká reakcí plynu amoniaku (NH3) s plynem chlorovodíku (HCl). V NH4+ je čtvrtý vodík připojen souřadnicovou kovalentní vazbou, protože z chloru na dusík se přenáší pouze jádro vodíku. Vodíkový elektron je ponechán na chloru za vzniku negativního chloridového (Cl–) iontu.
fluorid amoniaku (NH3. BF3)
fluorid Boru (BF3) je sloučenina, která nemá strukturu vzácného plynu kolem atomu boru (B). Bór má ve svém valanovém plášti pouze tři páry elektronů a vyžaduje pár k dokončení orbitalu. Proto má BF3 nedostatek elektronů. Osamělý pár na dusíku (N) molekuly amoniaku (NH3) se používá k překonání tohoto nedostatku a komplexní sloučenina se tvoří prostřednictvím souřadnicové kovalentní vazby.
Vodíku iontů (H3O+)
Když chlorovodík (HCl) plyn se rozpouští ve vodě, aby se kyselina chlorovodíková (HCl aq.), vzniká v hydroniovém iontu souřadnicová kovalentní vazba. Jádro vodíku (H) se přenáší do molekuly vody (H2O), která má osamělý pár elektronů za vzniku hydronia. Takže H nepřispívá k vazbě žádné elektrony.
Chlorid hlinitý (Al2Cl6)
lepení v chloridu hlinitého (AlCl3) je v podstatě kovalentní. Každý atom hliníku (Al) má ve svém valanovém plášti deficit dvou elektronů a chlor (Cl) má osamělý pár. Al tvoří souřadnicovou kovalentní vazbu s atomem Cl na sousední skupině AlCl3. Jak to dělá každý ze dvou atomů Al, pak chlorid hlinitý je kovalentní dimerová molekula se vzorcem Al2Cl6.
oxid uhelnatý (CO)
uhlík (C) má ve své valenční skořápce čtyři elektrony a kyslík (O) má šest. Uhlík i kyslík sdílejí své dva elektrony. Zatímco oktetové pravidlo je spokojeno s kyslíkem, na uhlíku je stále deficit dvou elektronů. Takže, kyslík sdílí své dva elektrony s uhlíkem tvoří koordinovat kovalentní vazby, kromě dvou pravidelné (dvakrát) kovalentní vazby.