Aprendiz de Química
¿Qué es un Enlace Covalente de Coordenadas?
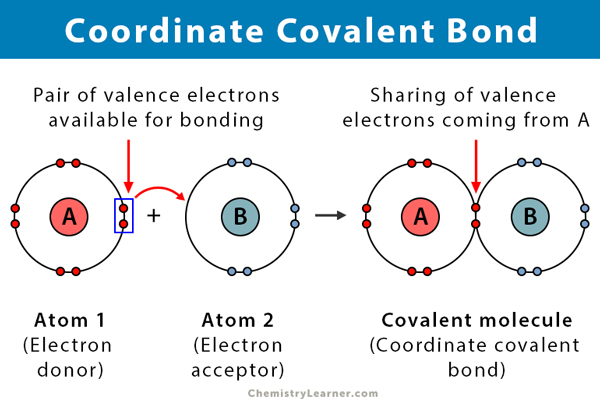
Se forma un enlace covalente cuando dos átomos comparten electrones. Un enlace covalente coordinado, también conocido como enlace covalente dativo, es un tipo de enlace covalente en el que el par compartido de electrones proviene de uno de los átomos. Los átomos se mantienen unidos porque ambos núcleos atraen el par de electrones. Una vez que se forma el enlace covalente, es imposible distinguir el origen de los electrones. Este tipo de unión se observa típicamente en la unión de iones metálicos a ligandos. Sin embargo, los no metales también pueden participar en esta unión. La reacción entre el ácido de Lewis y la base es un enlace covalente coordinado .
Un ion complejo está hecho de dos cosas, un ion metálico y compuestos llamados ligandos. Los ligandos son moléculas neutras o iones que contienen pares de electrones solitarios que pueden unirse con el ion metálico. Los ligandos comunes son amoníaco (NH3), agua (H2O) e iones de haluro (Cl–, Br–). Los ligandos se consideran bases de Lewis porque comparten sus pares de electrones con el ion metálico. Los iones metálicos son siempre positivos, por lo que son bastante atractivos para pares solitarios de electrones.
Hechos y propiedades del Enlace Covalente de coordenadas
El enlace covalente de coordenadas tiene muchas similitudes con el enlace covalente. Estas son algunas de sus propiedades:
- Tiene lugar entre un donante de electrones y un aceptor de electrones, típicamente entre un metal y un ligando
- Tiene lugar entre átomos diferentes
- Formados por el intercambio de electrones donados por uno de los átomos
- Rígidos y direccionales
- Polares
- Los átomos siguen la regla de octetos
- El átomo que dona los electrones se llama donante, y el átomo que los acepta se llama aceptador.
- Los compuestos son escasamente solubles en agua
Ejemplos de Enlace covalente de coordenadas
Aquí hay algunos ejemplos de moléculas donde existe enlace covalente de coordenadas .
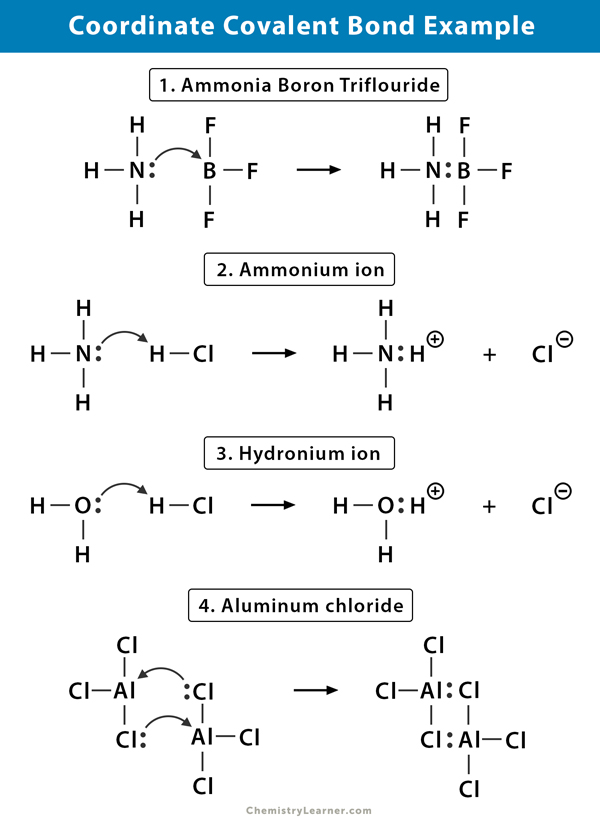
ion de amonio (NH4+)
El ion de amonio se forma a partir de la reacción del gas amoniaco (NH3) con gas de cloruro de hidrógeno (HCl). En NH4+, el cuarto hidrógeno está unido por un enlace covalente coordinado porque solo el núcleo del hidrógeno se transfiere del cloro al nitrógeno. El electrón del hidrógeno se deja en el cloro para formar un ion cloruro negativo (Cl–).
El trifluoruro de boro amoniacal (NH3.BF3)
El trifluoruro de boro (BF3) es un compuesto que no tiene una estructura de gas noble alrededor del átomo de boro (B). El boro solo tiene tres pares de electrones en su envoltura de cenefa y requiere un par para completar el orbital. Por lo tanto, BF3 es deficiente en electrones. El par solitario en el nitrógeno (N) de la molécula de amoníaco (NH3) se utiliza para superar esa deficiencia, y un compuesto complejo se forma a través de un enlace covalente coordinado.
Ion hidronio (H3O+)
Cuando el gas de cloruro de hidrógeno (HCl) se disuelve en agua para producir ácido clorhídrico (HCl aq.), se forma un enlace covalente coordinado en el ion hidronio. El núcleo de hidrógeno (H) se transfiere a la molécula de agua (H2O), que tiene un par solitario de electrones para formar hidronio. Por lo tanto, H no contribuye ningún electrón al enlace.
Cloruro de Aluminio (Al2Cl6)
La unión en cloruro de aluminio (AlCl3) es esencialmente covalente. Cada átomo de aluminio (Al) tiene un déficit de dos electrones en su envoltura de cenefa, y el cloro (Cl) tiene un par solitario. Al forma un enlace covalente de coordenadas con el átomo Cl en un grupo AlCl3 adyacente. Como cada uno de los dos átomos de Al hace esto, el cloruro de aluminio es una molécula de dímero covalente con la fórmula Al2Cl6.
Monóxido de carbono (CO)
El carbono (C) tiene cuatro electrones en su envoltura de valencia, y el oxígeno (O) tiene seis. Tanto el carbono como el oxígeno comparten sus dos electrones. Aunque la regla del octeto se cumple con el oxígeno, todavía hay un déficit de dos electrones en el carbono. Por lo tanto, el oxígeno comparte sus dos electrones con el carbono para formar un enlace covalente coordinado, además de los dos enlaces covalentes regulares (dobles).