Slab în genunchi: sindromul Miller Fisher
sindromul Miller Fisher (MFS), o variantă rară, autolimitantă a sindromului Guillain-Barrcq (GBS), este un sindrom anticorp anti-GQ1bIgG care afectează sistemul nervos periferic și central.1 o afecțiune polineuropatică neuromusculară acută, MFS provoacă o paralizie ascendentă cu o triadă clasică de prezentare a oftalmoplegiei, ataxiei și areflexiei. Cercetătorii au descris pentru prima dată triada clinică în 1932.1 două decenii mai târziu, specialistul canadian în accident vascular cerebral Charles Miller Fisher a fost primul care a publicat un raport în 1956 care a descris constatările clinice și a definit afecțiunea ca o formă limitată de GBS.2
simptomele apar pe parcursul mai multor zile, adesea iarna și primăvara, de obicei după o infecție virală, iar pacienții prezintă adesea diplopie ca unul dintre primele simptome. Atunci când un pacient prezintă simptome cum ar fi esotropia intermitentă, preocupări orizontale afectate și pupile midriatice fixe, iar examenul neurologic este anormal, este timpul să ne gândim la GBS, în special la MFS. Următorul caz ilustrează semnele și simptomele relevante și reflectă rezultatul tipic.
istoric
Un bărbat caucazian în vârstă de 27 de ani s-a prezentat la Clinica de ochi VA în lunile de primăvară raportând diplopie binoculară cu debut acut care a început cu o zi înainte. Pacientul a declarat că a fost constant, dar a avut loc doar la vizualizarea la distanță cu obiecte deplasate orizontal. Nu au existat dureri oculare sau vedere încețoșată asociate cu diplopia. De asemenea, s-a plâns de amețeli recente și dificultăți de echilibru. El a raportat o infecție sinusală cu congestie paranazală semnificativă care a început cu o săptămână înainte de vederea dublă. Istoricul ocular și medical anterior nu era remarcabil; pacientul nu lua în prezent niciun medicament și nu avea alergii la medicamente.
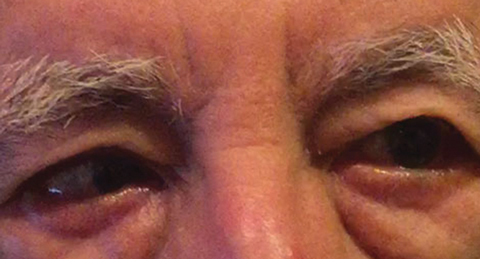
Fig. 1. Diagnosticul diferențial după examinarea inițială a inclus o paralizie parțială CN VI dreaptă, care ar putea indica o afecțiune vasculară, așa cum se vede aici la un alt pacient. Faceți clic pe imagine pentru a mări. Foto: Michael DelGiodice, OD
date diagnostice
la examinarea inițială, acuitățile vizuale necorectate au fost 20/20-2 OD și 20/25-2 OS. Elevii au fost de 5 mm la fel de rotunzi și reactivi la lumină, fără defecte pupilare aferente. Motilitățile extraoculare erau pline, netede și precise în ambii ochi, fără restricții. Testul de acoperire la distanță a relevat o intermitentă de patru până la șase dioptrii de prismă esotropia dreaptă în privirea primară care apare aproximativ 50% din timp. Efectuarea testului de acoperire la near a dezvăluit o esoforie cu dioptrii cu patru prisme în privirea primară fără tropia.
deși nu sunt întreprinse în acest caz, clinicienii ar trebui să acopere testul în privirea primară, dreaptă și stângă. La pacienții cu diplopie, paralizia nervului cranian șase (CN VI) se va manifesta ca abatere necomitantă, mai gravă în privirea dreaptă sau stângă, în funcție de ce parte se află paralizia. O forie decompensantă va arăta, pe de altă parte, o abatere comitantă.
eroarea de refracție a fost -0.50 d sphere OD și -0.75 d sphere OS și viziunea a fost corectabilă la 20/20 în fiecare ochi. Presiunile intraoculare au fost în limite normale la ambii ochi. Constatările segmentului Anterior și posterior au fost nesemnificative în ochii drepți și stângi. Nervii optici au apărut sănătoși, cu un raport cupă-disc de 0,15 la ambii ochi.
diagnosticul diferențial a inclus o paralizie parțială CN VI dreaptă (Figura 1), miastenia gravis, un proces de compresiune și o esoforie la distanță decompensantă care provoacă o esotropie dreaptă intermitentă. Pacientul a negat orice istoric anterior de diplopie binoculară.
imagistica creierului și a orbitelor a fost comandată de clinica de ochi pentru a exclude implicarea creierului, inclusiv o leziune compresivă. Tomografia computerizată (CT) scanează creierul și orbitele au fost efectuate și interpretate de neuroradiologul personalului. CT a fost ales în locul imagisticii prin rezonanță magnetică (RMN) datorită calendarului și disponibilității; testarea și rezultatele ar putea fi obținute în aceeași zi cu CT în clinică după ore. Rezultatele au fost nesemnificative, fără semne de hemoragie intracraniană, leziune compresivă sau infarct acut.
CT a sinusurilor paranazale a evidențiat o boală sinusală cronică paranazală moderată până la severă și opacifierea completă a sinusului maxilar drept. Nu a existat nicio extensie pe orbită. Medicul de familie al pacientului a fost informat cu privire la simptomele pacientului, rezultatele examenului ocular și rezultatele imagistice CT și a început tratamentul pentru sinuzită maxilară cu un pachet de doze orale de azitromicină de cinci zile și a instruit pacientul să urmărească Clinica de ochi.
pacientul s-a întors cinci zile mai târziu după terminarea cursului oral de azitromicină și a declarat că nu a prezentat nicio îmbunătățire a diplopiei la distanță; în plus, a prezentat apariția fotofobiei semnificative și a durerii perioculare în jurul ambilor ochi. Pacientul a declarat că dezechilibrul său de mers și dificultățile de mers se înrăutățeau. La examinare, acuitățile vizuale cel mai bine corectate au rămas 20/20 în ochii drepți și stângi. Pupilele au fost dilatate la 8,5 mm fără reactivitate la lumină în nici un ochi (figura 2). Motilitățile extraoculare au evidențiat restricție laterală cu durere la mișcarea ochiului drept și restricție medială cu durere la mișcarea ochiului stâng în concordanță cu o paralizie a privirii drepte (Figura 3). Căutările orizontale și verticale au fost sacadice cu mișcări inexacte și sacadate. Constatările segmentului Anterior și posterior au rămas neremarcabile OU.
diagnosticul diferențial după examinarea oftalmologică a inclus oftalmoplegia internucleară stângă, paralizia privirii drepte și paralizia privirii drepte cu oftalmoplegia internucleară stângă, care ar putea explica constatările motilității extraoculare. Alte diferențiale includ o leziune a creierului mijlociu sau miastenia gravis. Diagnosticul diferențial pentru dilatarea pupilei include paralizia celui de-al treilea nerv (CN III), trauma și dilatarea farmacologică. Pacientul nu a avut alte constatări în concordanță cu o a treia paralizie nervoasă și a negat trauma sau expunerea la agenți farmacologici.
pacientul a fost trimis la neurologie pentru o evaluare ulterioară. Examenul neurologic a raportat că pacientul a fost complet alert și orientat fără pierderea senzației faciale. Pacientul a prezentat ataxie ușoară, cu dificultăți de mers în tandem și în picioare dintr-o poziție ghemuită. Au fost prezente slăbiciune proximală atât la extremitățile superioare, cât și la cele inferioare și reflexe anormale. Toate modalitățile senzoriale erau intacte. RMN și angiografia prin rezonanță magnetică (MRA) a creierului și a orbitelor au fost de neimaginat. Proteina lichidului cefalorahidian a fost crescută la 75 mg/dL (interval de referință: 15 mg/dL până la 45 mg/dL) fără alte anomalii. Testarea electromiogramei a fost de neimaginat și nu a arătat anomalii ale conducerii nervoase de la coloana vertebrală la picioare și mâini.
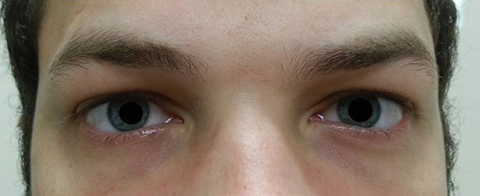
Fig. 2. Pupilele pacientului au fost dilatate cu 8,5 mm, fără reactivitate la ochii drepți sau stângi. Faceți clic pe imagine pentru a mări.
diagnostic
pacientul a prezentat simptome acute de diplopie, ataxie și areflexie. Având în vedere esotropia dreaptă intermitentă, urmărirea orizontală afectată, pupila midriatică fixă, ataxia ușoară și reflexele anormale la examenul neurologic și creșterea proteinei lichidului cefalorahidian, s-a pus diagnosticul MFS. Pacientul a fost internat la spital pentru a monitoriza orice alte complicații. Pacientului i s-a furnizat un plasture pentru a acoperi ochiul drept, după cum este necesar pentru diplopie.
nu există în prezent criterii de diagnostic publicate pentru sindromul Miller Fisher. Diagnosticul se face de obicei prin prezentarea triadei clinice împreună cu imagistica și studiile de lichid cefalorahidian. RMN – ul este de obicei neremarcabil în afecțiune, deși unele studii au arătat leziuni centrale la nivelul creierului mediu, pons și medulla inferioară. Studiile electrofiziologice arată o conducere senzorială periferică redusă sau anormală.17
proteina lichidului cefalorahidian este adesea crescută fără alte rezultate anormale. Într-un studiu de referință, 64,4% dintre pacienții cu MFS au prezentat proteine lichide spinale crescute.8 un test pozitiv de anticorpi IgG anti-GQ1b permite un diagnostic definitiv. Într-un studiu, anticorpul IgG anti-GQ1b a fost prezent la până la 95% dintre pacienții cu această afecțiune și absent în grupurile de control.3
neurologul a diagnosticat pacientul cu MFS pe baza triadei clinice de oftalmoplegie, ataxie și areflexie, un RMN neremarcabil și MRA ale creierului și proteine crescute ale lichidului cefalorahidian. Prin urmare, testarea anticorpilor IgG anti-GQ1b nu a fost efectuată în acest caz.
Mai multe caracteristici clinice ale MFS sunt, de asemenea, observate în sindromul Guillain-Barracoux și encefalita trunchiului cerebral Bickerstaff, ceea ce face diagnosticul provocator. Pacienții cu doar Guillain-Barracus prezintă slăbiciune la nivelul membrelor, pierdere senzorială, neuropatie craniană și areflexie fără manifestări oftalmologice. Pacienții cu encefalită cerebrală Bickerstaff prezintă de obicei oftalmoplegie, ataxie, hiper-reflexie și o conștiință perturbată. Deoarece mai multe simptome și semne sunt prezente în toate cele trei condiții, testarea titrului de anticorpi IgG anti-GQ1b este utilă pentru un diagnostic mai definitiv. Anticorpul IgG Anti-GQ1b este pozitiv la o mare majoritate a pacienților cu sindrom Miller Fisher, comparativ cu 66% în encefalita brainstemului Bickerstaff și 26% dintre pacienții cu sindrom Guillain-Barrciflux.16
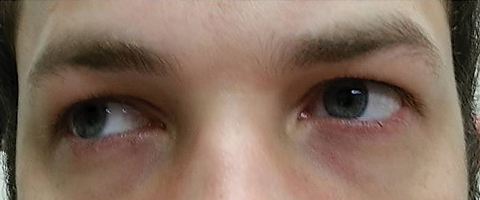
Fig. 3. Motilitățile extraoculare au evidențiat restricții în dextroversie. Faceți clic pe imagine pentru a mări.
tratament și urmărire
pacientul a fost evaluat A doua zi după internare, când a declarat că nu a prezentat modificări vizuale sau îmbunătățiri ale echilibrului. Diplopia binoculară era încă constantă; prin urmare, ochiul drept a rămas patch-uri. Durerea ochilor cu priviri îndepărtate și mișcări rapide ale ochilor erau încă prezente. La examinarea limitată a patului, acuitățile vizuale cel mai bine corectate au rămas 20/20 în ochii drepți și stângi. Pupilele au fost dilatate la 8.0mm în ambii ochi cu reactivitate minimă, care a fost ușor îmbunătățită față de ziua precedentă. Vederea culorilor era normală în ochii din dreapta și din stânga. Motilitățile extraoculare erau pline în toate cadranele, cu durere încă prezentă pe privirile orizontale îndepărtate. Urmăririle orizontale au rămas sacadice cu mișcări sacadate și nistagmus final. Nervii optici au apărut sănătoși, cu margini distincte și un raport cupă-disc de 0,15 la ambii ochi.
la două zile după aceea, pacientul a declarat o îmbunătățire a tuturor simptomelor și că ochii lui „se simt mai bine astăzi decât au fost de ceva vreme.”Durerea oculară și diplopia binoculară au fost ambele rezolvate. Acuitățile vizuale au rămas 20/20 în ochii drepți și stângi. Dimensiunile pupilelor au fost de 7,5 mm în întuneric și 7,0 mm în lumină, cu răspunsuri directe și consensuale îmbunătățite la ambii ochi. Motilitățile extraoculare erau pline în toate cadranele, fără dureri oculare. Urmăririle orizontale au rămas sacadice cu mișcări sacadate și nistagmus final. Examenul neurologic a relevat reflexe anormale, care au rămas stabile. Opțiunile de tratament pentru MFS includ plasmafereza și imunoglobulina IgG intravenoasă (IV), dar acestea au fost reținute având în vedere îmbunătățirea oftalmoplegiei și ataxiei.patru zile mai târziu, pacientul a raportat că toate simptomele s-au îmbunătățit, cu unele dificultăți de focalizare și urmărire în timpul utilizării computerului. Soldul a fost rezolvat în proporție de 80% și au existat puține apariții ale diplopiei la distanță. Acuitățile au rămas 20/20 OU. Elevii au fost 5.5 mm în întuneric și 4.0 mm în lumină cu 3 + răspunsuri directe și consensuale OU. Motilitățile extraoculare erau pline în toate cadranele, fără dureri oculare. Căutările orizontale au fost îmbunătățite, fără mișcări saccadice. Cazarea monoculară a fost normală, care a fost măsurată cu 8,5 și 9 dioptrii prismali OD și, respectiv, OS.
o săptămână mai târziu, pacientul a raportat că vederea sa a revenit la aproape normal, fără diplopie și dificultăți ușoare de focalizare și urmărire. Soldul a fost rezolvat 100%. Acuitățile vizuale au rămas 20/20 în ochii drepți și stângi. Dimensiunile pupilelor au fost de 5,5 mm în întuneric, 4,0 mm în lumină cu 4+ răspunsuri directe și consensuale OU. Motilitățile extraoculare erau pline în toate cadranele, fără dureri oculare. Urmăririle orizontale s-au îmbunătățit fără mișcări saccadice observate. Sănătatea oculară era de neimaginat.
tratamentul a fost întrerupt având în vedere Rezoluția oftalmoplegiei și ataxiei cu areflexie stabilă. Recuperarea completă a optalmoplegiei și ataxiei a durat două săptămâni. Tratamentul a inclus monitorizarea atentă și urmărirea în patru săptămâni; pacientul a fost sfătuit să revină mai devreme dacă oricare dintre simptomele sale a revenit.
caracteristici clinice
în studiile bine descrise ale MFS, toți pacienții au prezentat triada Clinică de oftalmoplegie, ataxie și areflexie.4,5 debutul simptomelor apare de obicei pe parcursul mai multor zile, iar pacienții suferă o infecție virală cu una până la patru săptămâni înainte de debutul simptomelor clinice.4,5 conform unui studiu efectuat pe 50 de pacienți cu această afecțiune, intervalul mediu dintre debutul infecției și dezvoltarea simptomelor neurologice este de opt zile.4 alte semne ale MFS includ vorbirea neclară, dificultăți la înghițire și o expresie facială anormală cu incapacitatea de a zâmbi sau de a fluiera.
caracteristici oftalmologice. Practicienii ar trebui să fie în căutarea midriazei, retragerii capacului, închiderii unghiului acut și diplopiei secundare palmelor nervoase care afectează CN III, IV și VI.3,8,10,22,24 Diplopia este cel mai frecvent simptom oftalmologic raportat în multe studii MFS.8,16,25,26,27 Diplopia este, de asemenea, simptomul inițial raportat la 38,6% din 223 de pacienți într-un studiu de referință și la 65% din 466 de pacienți într-un al doilea studiu.8,27 în cel de-al doilea studiu, 100% dintre pacienți au prezentat oftalmoplegie externă, în timp ce oftalmoplegia internă a fost prezentă la 35% dintre pacienți.27 oftalmoplegia externă se referă la afectarea mușchilor extraoculari externi. Oftalmoplegia internă se referă la afectarea sfincterului pupilar și a mușchiului ciliar. Oftalmoplegia completă afectează atât mușchii externi, cât și cei interni.
într-un studiu retrospectiv la 19 pacienți cu SFM, toți au prezentat una sau mai multe paralizii nervoase care afectează mușchii extraoculari.25 alte studii arată că pacienții cu MFS pot prezenta multiple palisări ale nervilor cranieni, care se pot manifesta bilateral.22,24,25 o constatare comună găsită în rândul tulburărilor pozitive IgG anti-GQ1b este deficitul de răpire în concordanță cu o paralizie unilaterală sau bilaterală CN VI.26,28 oftalmoplegia internă provoacă midriază pupilă, unde constricția pupilei la lumină și / sau stimulare apropiată poate varia de la minim la absent.8,26 într-un raport, midriaza a fost prezentă la 42% dintre pacienți. Implicarea NC VII a apărut la aproximativ 45,7% dintre pacienții cu SMF, provocând slăbiciune facială, incapacitate de a zâmbi sau de a fluiera.8
ataxie. Cauza acestei caracteristici clinice în MFS nu este pe deplin înțeleasă. Există dezbateri dacă ataxia este cauzată de disfuncție centrală în cerebel sau periferic. Prima ipoteză, propusă de Dr. Fisher, a postulat implicarea neuronilor Ia-aferenți.2 Acest lucru a fost susținut de un al doilea studiu decenii mai târziu, care a arătat anomalii ale fibrelor Ia-aferente în MFS.11 implicarea anormală a nervilor periferici a fost, de asemenea, propusă cu o nepotrivire între aportul proprioceptiv de la fusurile musculare și informațiile kinestezice de la receptorii articulari.12
au existat, de asemenea, dovezi justificative că ataxia își are originea în cerebel. O predominanță a anticorpului IgG anti-GQ1b în cerebel a fost găsită utilizând colorarea imunocitochimică a cerebelului uman și confirmată în continuare cu studiile western blot, care au arătat o creștere a anticorpului IgG anti-GQ1b la pacienții cu MFS comparativ cu controlul, deși mecanismul de implicare cerebeloasă nu a fost studiat.13,14 în 2015, cercetătorii au publicat un raport de caz al unui pacient MFS care a suferit RMN. A existat un raport redus de n-acetilaspartat/creatină, sugerând disfuncție cerebeloasă, care a revenit la normal la 2,5 luni după recuperare.23
areflexie. Această caracteristică clinică, împreună cu depresia reflexelor profunde ale tendonului, este un semn al implicării sistemului nervos periferic în MFS. Studiile electrofiziologice au validat conducerea anormală a nervilor periferici în GBS și MFS.3 într-un studiu, 81,6% din cazurile MFS au prezentat arefexie.8 Un alt studiu de referință a arătat că toți pacienții au prezentat areflexie, care era încă prezentă la șase luni de la debut.4
cât de comună este MFS?
datele epidemiologice privind sindromul Miller Fisher sunt limitate. Incidența MFS este destul de rară, apărând la 0,09 la 100.000 de persoane anual.3 MFS apare mai frecvent la pacienții cu sindrom Guillain-Barriqq, de la 3% la 25%.4,6,7 această asociere apare mai mult la pacienții cu descendență din Orientul Îndepărtat, sugerând o posibilă componentă genetică a MFS. Vârsta medie de debut este de 43 de ani, cu un interval de 13 până la 78,5 MFS afectează bărbații de două ori mai mult decât femelele cu un raport de două până la 1,03,5 MFS apare mai mult în anotimpurile de iarnă și primăvară.5,6,8 cauza exactă a predilecției sezoniere nu a fost determinată, dar este probabil asociată cu natura postinfecțioasă a afecțiunii, deoarece s-a constatat că infecțiile bacteriene și virale declanșează un răspuns autoimun care determină producerea anticorpului IgG anti-GQ1b în MFS.
Fiziopatologie
fiziopatologia sindromului Miller Fisher nu este bine înțeleasă; cu toate acestea, există mai multe ipoteze din studiile imunologice și histologice. Este bine cunoscut faptul că afecțiunea se află în spectrul sindroamelor de anticorpi IgG anti-GQ1b, împreună cu sindromul Guillain-Barracoux și encefalita trunchiului cerebral Bickerstaff.
gangliozida GQ1b este un grup de lipide complexe implicate în sistemul nervos central și periferic. GQ1b este o componentă a structurii membranei plasmatice din nervii cranieni care alimentează mușchii extraoculari și este implicată în funcția celulară la joncțiunea neuromusculară presinaptică.
un mecanism autoimun de la o infecție declanșatoare precedentă va produce anticorpul IgG anti-GQ1b, care dăunează funcției gangliozide GQ1b, provocând demielinizare. Studiile histologice au arătat demielinizarea și umflarea axonală în nervii cranieni periferici și oculomotori.15 anticorpul anti-GQ1bIgG este absent la pacienții sănătoși, dar pozitiv la peste 90% dintre pacienții cu MFS.S-a constatat că 16,25
infecțiile bacteriene și virale declanșează un răspuns autoimun, determinând producerea anticorpului IgG anti-GQ 1b. Următorii agenți infecțioși care au fost asociați cu MFS includ pneumonia mycoplasma, HIV, Campylobacter jejuni, gripa Hemophilus, Helicobacter pylori și virusul Epstein-Barr.4,16 într-un raport care a analizat 466 de pacienți cu SMF, 90% au avut o boală antecedentă, inclusiv infecție respiratorie superioară, diaree sau ambele.27
prognostic și tratament
sindromul Miller Fisher este o boală autolimitantă și are un prognostic general pozitiv. Simptomele se ameliorează în general după câteva săptămâni, recuperarea completă apărând de obicei în două până la trei luni. Într-un studiu, recuperarea a început la o medie de 13 zile de la debutul simptomelor, iar rezoluția completă a oftalmoplegiei și ataxiei a apărut în șase luni.S-a constatat că 4,5 recidive apar în mai puțin de 3% din cazuri.4,5
deși MFS este de obicei autolimitată, complicațiile sistemice au fost asociate cu afecțiunea. Infecțiile respiratorii superioare au fost găsite la 56% până la 76% dintre pacienții cu MFS, care pot progresa până la insuficiență respiratorie care necesită ventilație mecanică.4,18,19 alte complicații grave rare includ cardiomiopatia, acidoza lactică și coma.3,20
opțiunile de tratament pentru SMF includ plasmafereza, imunoglobulina IgG IV și monitorizarea fără tratament. Cercetătorii postulează că plasmafereza și IgG IV pot fi eficiente pentru a accelera timpul de rezoluție, deoarece anticorpul Gq1b este IgG în clasă și timpul de înjumătățire al IgG este de aproximativ 21 de zile, care este mai lung decât timpul de înjumătățire de cinci până la șase zile al IgM și IgA.19 Cu toate acestea, nu au fost efectuate studii randomizate dublu-orb controlate cu placebo care să investigheze aceste tratamente.
Un studiu retrospectiv nu a reușit să arate că plasmafereza a modificat șansa de recuperare completă și timpul de rezolvare a ataxiei și oftalmoplegiei; în plus, intervalul de la debut până la începerea tratamentului cu plasmafereză nu a afectat timpul până la rezoluție sau severitatea simptomelor la debut. Cu toate acestea, un raport de caz indică faptul că plasmafereza este indicată atunci când este prezentă ataxie profundă, insuficiență motorie și respiratorie.21
pacienții trebuie monitorizați cu atenție pentru riscul de a dezvolta complicații sistemice grave, cum ar fi insuficiența respiratorie superioară. Studiile nu arată o îmbunătățire semnificativă a timpului de recuperare cu IgG IV sau tratament cu plasmafereză în MFS, astfel încât monitorizarea poate fi cea mai bună opțiune a unui medic.
deși este rară, afecțiunea nu trebuie să fie nediagnosticată. Recunoscând caracteristicile clinice cheie, practicienii pot dezvălui cauza simptomelor pacientului lor și pot câștiga încredere într-o recuperare completă. Dr. Wang și Cantrell sunt optometriști ai personalului de la Centrul Medical Orlando VA. Dr. Cali este un optometrist de personal la Clinica Lee County VA. Autorii doresc să-i mulțumească lui Joseph Miller, od, Paul Gruosso, OD și Vanessa Santos, OD, pentru asistență cu acest manuscris.
1. Collier J. nevrită periferică: prelegerile Morisa. Edinburgh Med J. 1932: 39: 601-18.
2. Fisher M. O variantă neobișnuită de polineurită idiopatică acută (sindromul oftalmoplegia, ataxia și areflexia). N Eng J Med. 1956:255:57-65.
3. Lo IL și colab. Spectrul clinic și imunologic al sindromului Miller Fisher. Nervul Muscular. 2007:36(5):615-27.
4. Mori M, Kuwabara S, Fukutake T, și colab. Caracteristicile clinice și prognosticul sindromului Miller Fisher. Neurologie. 2001:56(8): 1105-6.
5. Mori M, Kuwabara S, Fukutake T, și colab. Plasmafareza și sindromul Miller Fisher: analiza a 50 de cazuri consecutive. J Neurol Neurochirurg Psych. 2002:72:680.
6. Yuan CL, Wang YJ, Tsai CP. Sindromul Miller Fisher: un studiu retrospectiv bazat pe spital. Euro J Neurol. 2000:44(2):79-85.
7. Cheng BC, Chang WN, Chang CS și colab. Sindromul Guillain-Barrqqq în sudul Taiwanului: caracteristici clinice, factori de prognostic și rezultate terapeutice. Euro J Neurol. 2003:10 (6):655-62.
8. Berlit P, Rakicky J. sindromul Miller Fisher. Revizuirea literaturii. J neuro-oftalmologie clinică. 1992:12:57-63.
9. Lyu RK, Tang LM, Cheng SY și colab. Sindromul Guillain-Barrqqq în Taiwan: Un studiu clinic pe 167 de pacienți. J Neurol Neurochirurg Psych. 1997:63:494-500.
10. Tatsomoto m, Odaka m, Hirata K, Yuki N. paralizia abducens izolată ca o variantă regională a sindromului Guillain-Barriqq. J Neurol Sci. 2006:243:35-8.
11. Weiss JA, White JC. Corelarea conducerii aferente 1a cu ataxia sindromului Fisher. Nervul Muscular. 1986:9:327-32.
12. Das P, Biswash S, și colab. Varianta Miller Fisher a sindromului Guillain-barrixq: un raport de caz și o revizuire clinică. Bangabandhu Sheikh Mujib Medical Univer J. 2012: 5 (1):69-71
13. Kornberg AJ, Pestronk A, Blume GM și colab. Colorarea selectivă a stratului molecular cerebelos prin IgG seric al Miller Fisher și sindroamele conexe. Neurologie. 1996:47:1317-20.
14. Inoue n, Koh c, Iwahashi T. detectarea anticorpilor anticerebelari serici la pacienții cu sindrom Miller Fisher. Euro J Neurol. 1999:42:230-4.
15. Barontini F, Di Lollo s, Maurri s, Lambruschini P. localizarea procesului patologic în sindromul Miller Fisher. Italia J Neurol Sci. 1992:13:221-5.
16. Koga M, Yuki N, Takahashi M și colab. Asocierea strânsă a anticorpilor anti-gangliozidici IgA cu infecția antecedentă cu Campylobacter jejuni în sindroamele Guillain-Barrar și Fisher. J Neuroimunol. 2003:141:112-7.
17. Guiloff RJ. Conducerea nervului periferic în sindromul Miller Fisher. J Neurol Neurochirurg Psychiat. 1977:40:801-7.
18. Chikakiya H, Kunishige M, Yoshino H și colab. Neuropatie motorie și senzorială întârziată la un pacient cu encefalită a trunchiului cerebral. J Neurol Sci. 2005:234:105-8.
19. Arakata Y, Yoshimuro M, Kobayashi S și colab. Utilizarea imunoglobulinei intravenoase în sindromul Miller Fisher. Dezvoltarea Creierului J. 1993: 15:231-3.
20. Matsumoto H, Kobayashi O, Tamura K, și colab. Sindromul Miller Fisher cu comă tranzitorie: comparație cu encefalita brainstemului bickerstaff. Dezvoltarea Creierului J. 2002: 24: 98-101.
21. Yeh JH, Chen WH, Chen JR, și colab. Sindromul Miller Fisher cu implicare centrală: tratament de succes cu plasmafereză. Therap Afereza Dializa J. 1999:3: 69-71.
22. Papanikolaou T, Cath G, Boothman B și colab. Raport de caz: oftalmopareză bilaterală acută cu midriază areflexică pupilară în sindromul Miller-Fisher tratat cu imunoglobulină intravenoasă. J Ophthalmol. 2010; articol ID 291840.
23. Sandler RD, Hoggard N, Hadjivassiliou M. sindromul Miller-Fisher: ataxia este centrală sau periferică? Ataxii Cerebeloase. 2015:2:3.
24. Ejma M, Waliszewska-Pro-uri M, Hofman a, și colab. Sindromul subacut progresiv Miller-fisher tratat cu succes cu plasmafereză. Polonez J Neurol Neurochirurg. 2015;49(2):137-8.
25. San-Juan OD, Martiqqnez-Herrera JF, Moreno Garcia Oqua J, și colab. Sindromul Miller Fisher: 10 ani de experiență într-un centru de nivel al treilea. Euro Neurol. 2009; 62: 149-54
26. Snyder LA, Rismondo V, Miller NR. Varianta Fisher a sindromului Guillain-Barrix (sindromul Fisher). J Neurooftalmol. 2009 decembrie; 29 (4): 312-24.
27. Ito M, Kuwabara S, Odaka M și colab. Encefalita creierului Bickerstaff și sindromul fisher formează un spectru continuu: analiza clinică a 581 de cazuri. J Neurol. 2008;255:674-82.
28. Yuki N. pareza acută a mușchilor extraoculari asociați cu anticorpul IgG anti-GQ1b. Ann Neurol 1996; 39: 668-72.