Proiectarea sondelor FRET-TaqMan pentru PCR multiplex în timp real folosind un control pozitiv intern
Introducere
PCR în timp real permite monitorizarea continuă a fluorescenței fluoroforului în timpul generării produselor PCR într-un format tub închis. În prezent, metodele disponibile utilizează fie sonde etichetate, fie colorant de intercalare a ADN-ului pentru a monitoriza amplificarea produsului PCR. Sonda TaqMan este o oligonucleotidă monocatenară care conține un fluorofor și un stingător plasat la 10-30 de baze distanță. Sonda TaqMan este hidrolizată în timpul amplificării datorită activității exonucleazei specifice cu două catene 5′-3′ a polimerazei Taq care separă fluoroforul de stingător, rezultând o creștere a fluorescenței. Instrumentele PCR în timp real sunt echipate cu detectoare de fluorescență și software capabil să estimeze pragul ciclului (Ct), ciclul la care fluorescența este mai mare decât fluorescența de fundal, pentru reacții pozitive. Cu toate acestea, tehnica nu poate diferenția un rezultat negativ adevărat de un fals negativ atunci când PCR este afectat de inhibitori de amplificare. După extracția acidului nucleic, se raportează că inhibitorii pot fi încă prezenți din probe clinice (de exemplu, hemoglobină), probe de mediu (de exemplu, acizi humici și fulvici) și substanțe chimice utilizate în timpul extracției acidului nucleic (de exemplu, etanol, detergenți sau agenți chaotropici). Fiabilitatea testelor de diagnostic este crescută prin includerea unui acid nucleic de control intern care poate indica prezența și impactul inhibitorilor PCR (1,2). Un control pozitiv intern (IPC) este amplificat simultan în prezența unei secvențe țintă folosind un fluorofor etichetat care emite lumină la o lungime de undă diferită de fluoroforul utilizat pentru testul secvenței țintă, cu cei doi fluorofori detectați în canale diferite de instrumentul PCR în timp real. Controlul intern utilizat în mod obișnuit pentru PCR este o plasmidă care conține o secvență similară cu cea a țintei de testare, cu excepția regiunii sondei. Un număr limitat de molecule IPC sunt adăugate la ținta individuală de testare și co-amplificate cu acidul nucleic țintă; astfel, un semnal IPC pozitiv este o dovadă că reacția de amplificare a procedat suficient pentru a genera un semnal pozitiv din cantități foarte mici de acid nucleic țintă. Această caracteristică este importantă pentru a asigura amplificarea echivalentă a IPC și a acidului nucleic țintă (3-9). Cu toate acestea, unele dispozitive-cum ar fi LightCycler 1.2 și LightCycler 2 (Roche Applied Science, Indianapolis, IN, SUA), dispozitivul de identificare a agentului patogen avansat robust (R. A. P. I. D.) instrumentul (Idaho Technology, Salt Lake City, UT, SUA) și instrumentele PCR portabile în timp real-sunt echipate doar cu o singură sursă de lumină și un canal de emisie asociat. Multiplexarea pe aceste tipuri de instrumente necesită utilizarea oligonucleotidelor multi-etichetate și conceptul de transfer de energie prin rezonanță fluorescentă (FRET). Cu toate acestea, sondele FRET pot fi dificil de proiectat și pot lipsi de robustețe în regiunile hipervariabile și atunci când sunt prezente condiții de amplificare non-optime. Utilizarea sondelor FRET necesită identificarea a două regiuni pentru două sonde. Sistemul de sonde FRET se bazează pe hibridizarea adiacentă a oligonucleotidelor celor două sonde cu o singură etichetă, astfel încât fluorescența colorantului acceptor să fie detectată prin excitația fluoroforului atașat la a doua sondă. Un dezavantaj major al sondei FRET este cerința unei zone de secvență mai mari necesare pentru a găzdui două sonde adiacente cu un decalaj de 2-5 nucleotide. Există posibilitatea multiplexării cu alte sisteme de etichete, cum ar fi MegaStokes dye (DYXL; Dyomics, Jena, Germania) și Pulsar 650 (Biosearch Technologies, Inc., Novato, CA, SUA), dar aceste sisteme de etichetare necesită informații spectrale pentru a compensa crosstalk-ul canalului și nu sunt disponibile pe scară largă. Cu toate acestea, sonda FRET-TaqMan dezvoltată în acest studiu nu necesită software de compensare a culorilor și utilizează fluorofori (Fam, Cy5.5) care sunt disponibili pe scară largă. Prezentul raport se concentrează pe proiectarea unei sonde cu etichetă triplă pentru a permite multiplexarea în instrumente echipate cu o singură sursă de excitație cu diodă emițătoare de lumină albastră (LED) (470 nm) și trei canale de detectare corespunzătoare asociate (de exemplu, 530 nm, 640 nm și 705 nm).
materiale și metode
principiul proiectării sondei
toate experimentele au fost efectuate pe sistemul R. A. P. I. D. al Idaho Technology, un instrument PCR portabil în timp real cu 32 de eșantioane echipat cu un LED albastru pentru excitație (470 nm) și trei canale asociate de detectare a fluorescenței care măsoară fluorescența la 530, 640 și 705 nm pentru testele mono-și dual-color. Primerii JVAF și JVAR (10) și sonda 5′-FAM/BHQ-1 au fost sintetizați la instalația CDC Biotechnology Core (Atlanta, GA, SUA), iar sonda 5 ‘FAM-Cy5.5/3′ BHQ-3 a fost sintetizată la tehnologia Idaho. Pentru a activa Duplex Taqman PCR, o sondă a fost etichetată cu 5’-FAM/BHQ-1 (lungime de undă de fluorescență de 520 nm) și alta cu 5 ‘FAM-Cy5.5/3’ BHQ-3 (lungime de undă de fluorescență de 705 nm). În soluție, sonda etichetată cu 5 ‘FAM-Cy5.5/3’ BHQ-3 rămâne stinsă la hibridizare la o secvență, iar la scindarea ulterioară a sondei prin extensia primerului enzimatic, stingătorul este eliminat. Acest lucru duce la FRET prin excitarea FAM de către sursa de lumină a instrumentului R. A. P. I. D. Energia de excitație este transferată la fluoroforul acceptor, Cy5.5, iar fluorescența emisă este măsurată într-un al doilea canal de fluorescență (canalul de fluorescență F3 pentru instrumentul R. A. P. I. D.). Emisia de fluorescență Cy5.5 este rezultatul combinației de tehnici de sondă FRET și TaqMan, astfel încât aceste sonde triple-etichetate pot fi denumite sonde „FRET-TaqMan”.
primeri, sonde și plasmidă
pentru a demonstra capacitățile de multiplexare ale designului FRET-TaqMan, am folosit un test PCR în timp real Cryptosporidium specific genului pentru a amplifica o porțiune de 159-bp a genei ARNr 18S (10). Primerul înainte (JVAF) a fost 5′-ATGACGGGTAACGGGGAAT-3′, primerul invers (JVAR) a fost 5′-CCAATTACAAAAC-CAAAAAGTCC-3′, iar sonda TaqMan (JVAP) a fost 5′-FAM-CGCGCCTGCT-GCCTTCTTAGATG-BHQ1–3′, corespunzând nucleotidelor 100-118, 258-236 și 184-161, respectiv, din GenBank accession nr. AY458612. Primerii pentru construcția Cryptosporidium IPC conțineau același set de secvențe de primeri raportate pentru amplificarea Cryptosporidium spp., cu excepția regiunii de legare a sondei ADN-ului țintă, care a fost înlocuită cu secvența artificială 5′-TTGTGCTCGTAGTCGCCTCTGTCTCT-3′ (JPIPC). Această secvență de sondă a avut o temperatură de recoacere de 69 centi C și a fost proiectată să nu aibă o structură secundară. Specificitatea teoretică pentru sonda internă a fost stabilită printr-o căutare explozivă (11) a secvențelor sondei și a primerului în care nu s-a găsit nicio potrivire exactă cu nicio secvență de Criptosporidium. Fragmentul IPC a fost sintetizat și clonat într-o plasmidă prin tehnologii ADN integrate (Coralville, IA, SUA). O concentrație cunoscută de ADN plasmidic (100 copii/reacție) a fost adăugată în amestecul principal al tuturor reacțiilor, cu excepția controlului negativ. O sondă triplă (JPIPC) specifică IPC a fost sintetizată prin tehnologia Idaho, așa cum se arată în Figura 1. Sonda oligo-nucleotidică Fam/Cy5.5 / BHQ3 a fost sintetizată începând de la capătul 3′ cu sticlă cu pori controlată non-fluorescentă (BHQ-3). Capătul 5 ‘a fost apoi conjugat cu un phosporamidit Cy5.5 urmat de un phosporamidit de fluoresceină (6-FAM) terminal 5’.
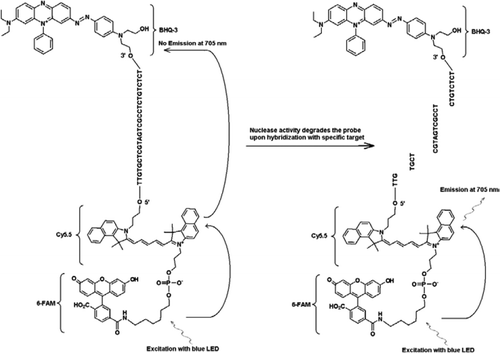
sonda FRET-TaqMan conține trei etichete: o bucată de stingere a găurilor negre la capătul brațului de 3′, un fluorofor emițător (Cy5.5) și un fluorofor de recoltat (FAM) Unite la capătul brațului său de 5′. FAM absoarbe eficient energia din LED-ul albastru ca sursă de lumină. În absența țintelor, sonda este întunecată, deoarece energia absorbită de FAM este transferată la Cy5.5 și, la rândul său, energia eliberată de Cy5.5 este transferat la stingător și se pierde ca energie termică. În prezența țintelor, sonda TaqMan este scindată de activitatea polimerazei Taq și se eliberează stingătorul și energia absorbită de FAM este transferată la Cy5.5 prin mecanismul FRET pentru a emite fluorescență la 705 nm.
test PCR în timp real
citometrie în flux sortate Cryptosporidium parvum oochists (200 oochists pe tub) obținute de la Universitatea din Wisconsin State Laboratory of Hygiene (Madison, WI, SUA). ADN-ul de la C. oochisturile parvum au fost extrase folosind un protocol descris de Hill și colab. (12) și suspendat în 80 de unktil Tris EDTA (TE, pH 8,0) tampon. S-au adăugat două micro-litri de ADN pe reacție, care corespundeau la 5 oochiste (echivalent cu 100 de copii ale ADN-ului țintă). Amestecul de reacție de amplificare a constat din amestecul de reacție Quantifast Probe PCR + ROX kit (Cat. 204354; Qiagen), fără adaos de ROX, primeri JVAF, jvar (0,4 oqtm fiecare), sondă JVAP (0,2 oqtm), sondă JPIPC (0,2 oqtm) și 100 de exemplare ale IPC. La capilarul de reacție s-a adăugat o alicotă (2 unqql) din proba de ADN extrasă (Roche Diagnostics, Indianapolis, IN, SUA) conținând 18 unqql amestec de reacție. Un control pozitiv al ADN-ului genomic C. parvum (Figura 2, graficul 1), plasmida IPC (Figura 2, graficul 2), un amestec de control pozitiv C. parvum și IPC (Figura 2, graficul 3) și un control fără șablon (NTC) format din apă fără nuclează (Cat. nu. Am9932; Ambion, Foster City, CA, SUA) în loc de ADN (Figura 2, graficul 4) au fost incluse în fiecare experiment. Protocolul a durat 30 de minute pentru a finaliza următoarele condiții PCR: etapa de denaturare la pornire la cald la 95% C timp de 3 minute, urmata de 45 de cicluri cu o denaturare de 95% C timp de 5%, 60% C recoacere de 30% cu o singura achizitie de fluorescenta (cu o viteza a rampei de temperatura de 20% C/s). Un rezultat pozitiv a fost înregistrat pentru FAM în canalul F1 (530 nm) și pentru Cy5.5 în canalul F3 (705 nm). Reacțiile de amplificare au fost efectuate în trei exemplare. Ampliconii (159 bp) au fost vizualizați prin electroforeză în gel de agaroză și colorare cu acid nucleic verde strălucitor (eenzima, Gaithersburg, MD, SUA) pentru a confirma specificitatea produsului PCR.
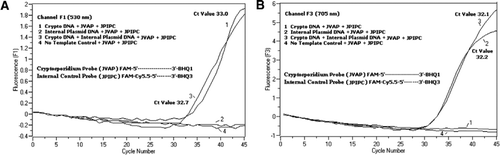
un amestec echimolar de FAM/BHQ1 și Fam/Cy5.5/BHQ3 a fost adăugat în toate amestecurile de reacție PCR. (A) monitoarele de canal F1 cresc fluorescența FAM pentru prezența C. parvum. Parcela 1 (Canalul F1 colectează în primul rând semnalul FAM) conținând numai C. ADN-ul parvum a dezvăluit semnalul Fam specific Cryptosporidium în PCR. Graficul 2 conținea doar ADN plasmidic și niciun semnal FAM de la sonda Fam/Cy5.5/BHQ3. Parcela 3 conținea ambele C. parvum și ADN plasmidic, dar a produs doar semnal FAM specific C. parvum. Graficul 4 a fost o probă negativă care conține numai apă fără nuclează în locul oricărui ADN șablon; nu s-a observat fluorescență din sonde. (B) monitoarele canalului F3 cresc în Cy5.5 pentru prezența ADN-ului plasmidic de control intern. Parcela 1 conținea doar ADN C. parvum și niciun semnal de fluorescență de la sonda FAM/ BHQ1. Graficul 2 (canalul F3 colectează în principal semnalul Cy5.5) conținând numai ADN plasmidic dezvăluit control plasmidic intern (IPC)–semnal Cy5.5 specific în PCR. Parcela 3 conținea ambele C. parvum și ADN plasmidic, dar a produs numai semnalul Cy5.5 specific IPC. Graficul 4 a fost o probă negativă care conține numai apă fără nuclează în locul oricărui ADN șablon; nu s-a observat fluorescență din sonde.
rezultate și discuții
semnale de fluorescență PCR în timp real care reflectă amplificarea ADN-ului genomic C. parvum a fost detectat în canalul F1 (figura 2a) datorită etichetării FAM a sondei TaqMan. Semnalul de fluorescență care reflectă amplificarea IPC a fost detectat în canalul F3 (figura 2b) datorită FAM/Cy5.5 etichetarea sondei IPC TaqMan. Această sondă a produs o creștere a Cy5.5 în canalul F3 (Cy5.5), dar nici o creștere a FAM în canalul F1 (FAM) atunci când BHQ3 este separat de FAM/Cy5.5 datorită activității nucleazei, deoarece energia a fost transferată de la FAM la Cy5.5. În mod similar, în reacția duplex, amplificarea ADN-ului genomic C. parvum a fost detectată în canalul F1, în timp ce amplificarea IPC a fost detectată simultan în canalul F3. FAM are o excitație la 495 nm și o emisie la 520 nm. Cy5.5 are o excitație de 690 nm și o emisie de 705 nm. Cu o proximitate atât de strânsă între Cy5.5 și FAM pe sonda IPC triplă, fluoroforul Cy5.5 emite fluorescență datorită transferului complet de energie din fluoroforul FAM, rezultând nicio emisie de fluorescență a FAM în canalul F1 (figura 2a). Reacțiile de control Negative nu au arătat o creștere a fluorescenței datorată FAM sau Cy5.5. Aceste rezultate demonstrează, de asemenea, că o singură sursă LED albastră (470 nm) este suficientă pentru a monitoriza emisiile de fluorescență duală prin canalele F1 (530 nm) și F3 (705 nm) fără nicio suprapunere spectrală în canalele de monitorizare respective pentru Fam și Cy5.5. Tehnica FRET-TaqMan a fost, de asemenea, testată folosind un panou de 12 extracte de ADN din specimene de scaun (8 din specimene determinate anterior ca fiind pozitive pentru Cryptosporidium spp. și patru specimene care au fost negative pentru Cryptosporidium spp.). Testul 18S rRNA a fost capabil să detecteze toate cele opt Cryptosporidium spp. S-a constatat că testul IPC TaqMan amplifică doar ADN-ul plasmidic IPC. Testul IPC a avut ca rezultat valori Ct de 32-37, care au indicat până la 5 valori Ct ale inhibării PCR pentru unele probe de scaun (32 a fost valoarea CT așteptată pentru reacțiile de inhibare).
tehnica actuală diferă de FRET utilizat în mod tradițional prin faptul că se folosește o sondă oligonucleotidică marcată fluorescent (sonda FRET-TaqMan) în loc de două sonde (sonde FRET) în care o sondă conține fluoroforul donator, iar cealaltă sondă conține fluoroforul acceptor (13,14). Sonda FRET-TaqMan este etichetată la capătul 5′ cu doi fluorofori de fluorofori donori (FAM) și acceptori (Cy5.5) și la capătul 3′ cu un quencher BHQ-3 ca o sondă TaqMan. Regiunea unică de legare a sondei este selectată pentru a se diferenția de ADN-ul țintă, astfel încât să monitorizeze două măsurători diferite de fluorescență în două canale de detectare diferite (530 nm în F1 și 705 nm în F3) din aceeași reacție de amplificare fără a fi nevoie să includă software de compensare a culorilor. ADN-ul țintă și IPC au avut aceleași site-uri de legare a grundului, dar o secvență de sondă diferită. Acest lucru asigură utilizarea acelorași primeri pentru ambele ținte ADN pentru a minimiza formarea primer-dimer sau interacțiunea dintre seturile de primeri. Când fluoroforii Fam / Cy5.5 sunt plasați îndeaproape la capătul 5′, transferul de energie de rezonanță are loc cu o creștere a emisiei de fluorescență a fluoroforului Cy5.5. Cu toate acestea, utilizarea BHQ3, un acceptor non-fluorescent pentru Cy5.5, scade fluorescența potențială de fundal, ceea ce duce la un raport semnal-zgomot mai mare. S-a constatat că adăugarea a 100 de exemplare ale IPC la o reacție care conține 100 de exemplare ale genomic C. ADN-ul parvum a avut ca rezultat valori Ct similare (Ct = 32) atunci când testul Cryptosporidium TaqMan a fost efectuat ca un test singleplex și ca un test duplex cu testul IPC TaqMan. Atunci când a fost aplicat pe un panou de probe ADN Criptosporidium-pozitive, IPC a indicat că unele probe nu conțin inhibitori PCR (pe baza valorilor CT așteptate de 32), dar alte probe au fost asociate cu inhibarea a până la 5 valori Ct.
controlul pozitiv PCR intern nou dezvoltat s-a dovedit a fi sensibil și specific pentru detectarea simultană a două ținte în aceeași reacție datorită etichetării cu fam/Cy5.5-BHQ3 și FAM / BHQ1 pentru gena țintă IPC și 18S rRNA respectivă într-un PCR multiplex cu două culori pentru monitorizarea în canalele de fluorescență F1 și F3 ale instrumentului R. A. P. I. D. Utilizarea sondei etichetate 5 ‘FAM-Cy5.5/3’ BHQ-3 ca al doilea reporter este avantajoasă, deoarece maximele de emisie ale celor două sonde au fost bine distanțate una de cealaltă. Designul sondei cu trei etichete FRET-TaqMan ar putea avea aplicații în dezvoltarea unui dispozitiv ieftin, de unică folosință „lab-on-A-chip”, cu optică constând dintr-o excitație LED albastră și două surse de emisie de 530 nm și 705 nm, cu filtre optice adecvate pentru a detecta FAM într-un canal și Cy5.5 în celălalt. Această combinație nu ar necesita două surse de fluorescență de mare putere și sisteme de detectare.
mulțumiri
autorii recunosc asistența lui Mike Powers la secvențierea ADN și facilitatea de bază genomică (Universitatea din Utah, Salt Lake City, UT, SUA) și Rachelle Muller la Idaho Technology, Inc. pentru discuții privind dezvoltarea controlului intern pozitiv pentru ciclatorul R. A. P. I. D. Această publicație a fost susținută parțial de fonduri puse la dispoziție prin Centrele pentru Controlul și Prevenirea Bolilor, Biroul de Coordonare pentru pregătirea terorismului și răspunsul la situații de urgență. Utilizarea denumirilor comerciale și a surselor comerciale este doar pentru identificare și nu implică aprobarea de către Centrele pentru Controlul și Prevenirea Bolilor sau Departamentul de sănătate și Servicii Umane din SUA.
- 1. Hartman, L. J., S. R. Coyne și D. A. Norwood. 2005. Dezvoltarea unui nou control intern pozitiv pentru testele bazate pe Taqman. Mol. Celula. Sonde 19: 51-59.Crossref, Medline, CAS, Google Scholar
- 2. Hoorfar, J., B. Malorny, A. Abdulmawjood, N. Cook, M. Wagner și P. Fach. 2004. Considerații practice în proiectarea controalelor interne de amplificare pentru testele PCR de diagnosticare. J. Clin. Microbiol. 42:1863–1868.Crossref, Medline, CAS, Google Scholar
- 3. Betsou, F., K. Beaumont, J. M. Sueur și J. Orfila. 2003. Construirea și evaluarea ADN-ului de control intern pentru amplificarea PCR a ADN-ului Chlamydia trachomatis din probele de urină. J. Clin. Microbiol. 41:1274–1276.Crossref, Medline, CAS, Google Scholar
- 4. Burggraf, S. și B. Olgemoller. 2004. Tehnică simplă pentru controlul intern al testelor de amplificare în timp real. Clin. Chem. 50:819–825.Crossref, Medline, CAS, Google Scholar
- 5. Drosten, C., M. Weber, E. Seifried și W. K. Roth. 2000. Evaluarea unui nou test PCR cu secvență competitivă de control intern pentru screeningul donatorului de sânge. Transfuzia 40: 718-724.Crossref, Medline, CAS, Google Scholar
- 6. Gruber, F., F. G. Falkner, F. Dorner și T. Hammerle. 2001. Cuantificarea ADN-ului viral prin PCR în timp real aplicând amplificarea duplex, standardizarea internă și detectarea fluorescenței în două culori. Appl. Environ. Microbiol. 67:2837–2839.Crossref, Medline, CAS, Google Scholar
- 7. Rosenstraus, M., Z. Wang, S. Y. Chang, D. DeBonville și J. P. Spadoro. 1998. Un control intern pentru PCR de diagnostic de rutină: proiectare, proprietăți și efect asupra performanței clinice. J. Clin. Microbiol. 36:191–197.Medline, CAS, Google Scholar
- 8. Stocher, M., V. Leb și J. Berg. 2003. O abordare convenabilă pentru generarea de ADN de control intern multiplu pentru un panou de teste PCR în timp real. J. Virol. Metode 108: 1-8.Crossref, Medline, CAS, Google Scholar
- 9. Zimmermann, K. și J. W. Mannhalter. 1996. Aspecte tehnice ale PCR competitiv cantitativ. Biotehnologii 21: 268-279.Link, CAS, Google Scholar
- 10. Jothikumar, N., A. J. da Silva, I. Moura, Y. Qvarnstrom și V. R. Hill. 2008. Detectarea și diferențierea Cryptosporidium hominis și Cryptosporidium parvum prin teste TaqMan duale. J. Med. Microbiol. 57:1099–1105.Crossref, Medline, CAS, Google Scholar
- 11. Altschul, S. F., W. Gish, W. Miller, E. W. Myers și D. J. Lipman. 1990. Instrument de bază de căutare aliniere locală. J. Mol. Biol. 215:403–410.Crossref, Medline, CAS, Google Scholar
- 12. Hill, V. R., A. M. Kahler, N. Jothikumar, T. B. Johnson, D. Hahn și T. L. Cromeans. 2007. Evaluarea multistată a unei proceduri bazate pe ultrafiltrare pentru recuperarea simultană a microbilor enterici în probele de apă de la robinet de 100 de litri. Appl. Environ. Microbiol. 73:4218–4225.Crossref, Medline, CAS, Google Scholar
- 13. Bernard, P. S., M. J. Lay și C. T. Wittwer. 1998. Amplificarea integrată și detectarea mutației punctului c677t în gena metilentetrahidrofolat reductazei prin transferul de energie prin rezonanță fluorescentă și curbele de topire a sondei. Anal. Biochem. 255:101–107.Crossref, Medline, CAS, Google Scholar
- 14. Wittwer, C. T., M. G. Herrmann, A. A. Moss și R. P. Rasmussen. 1997. Continuous fluorescence monitoring of rapid cycle DNA amplification. BioTechniques 22:130–138.Link, CAS, Google Scholar