postări etichetate „teoria MO; cicloadiție; chimie organică; HOMO; LUMO; sistem conjugat”
unul dintre cele mai provocatoare concepte în reacțiile sistemului conjugat este interacțiunile orbitale moleculare sau teoria MO. Elementele de bază ale acestui principiu pot fi greu de înțeles, dar vor fi foarte informative în prezicerea condițiilor corecte de reacție și a rezultatului reacției dacă le înțelegeți, ceea ce vă va oferi un avantaj major în viitoarele teste și examene. Noi, cei de la StudyOrgo, am conceput o explicație simplă a elementelor de bază ale teoriei MO pentru a vă ajuta cu pregătirile de studiu.
principiile teoriei MO
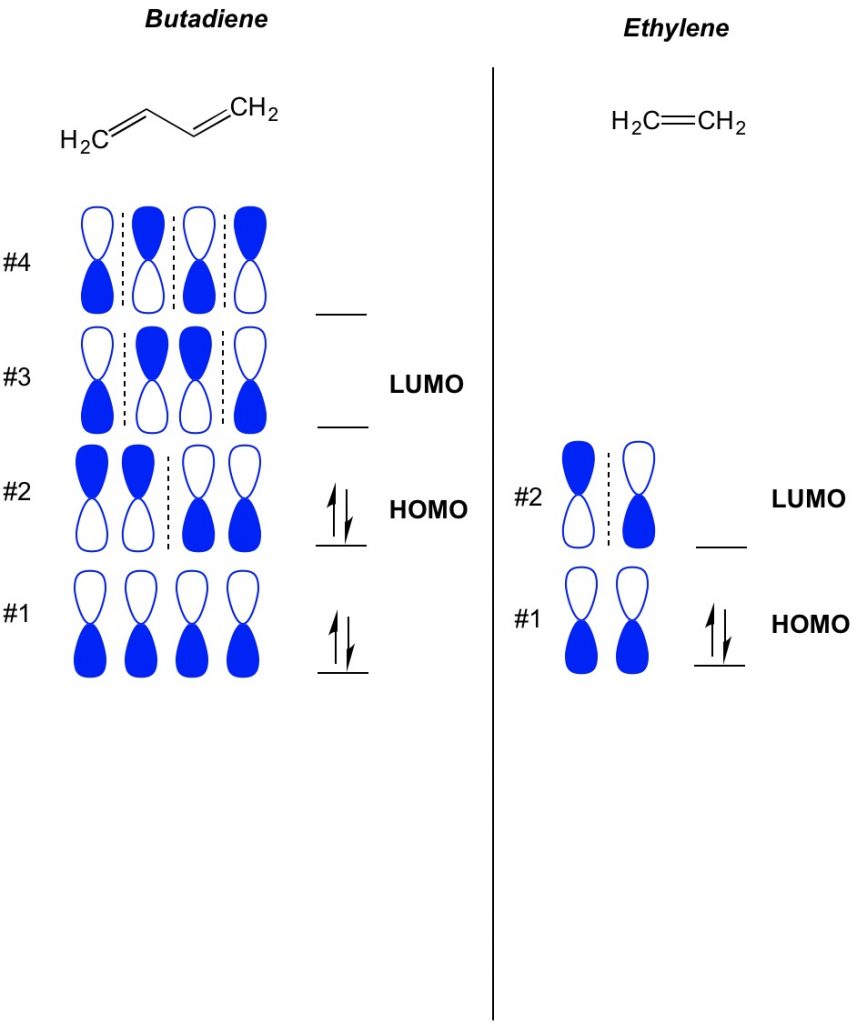
conceptul de bază al teoriei MO este de a descrie modelele alternative ale orbitalilor care există în sistemele de legături pi. Descriem orientarea fiecărei jumătăți a orbitalului ganterelor centrat în jurul unui atom ca fiind îndrăzneț sau deschis. Amintiți-vă, există orbitali de legătură și antibondare. În esență, orbitalii cu un număr mai mic de noduri (comutatoare în orientarea orbitalului dumbbell pe care îl arătăm cu linia punctată) se comportă mai mult ca orbitalii de legătură, în timp ce orbitalii cu un număr mai mare de noduri se comportă ca orbitalii anti-lipire. Pentru a determina ce orbitali sunt ocupați pe molecula dvs., numărați pur și simplu câte legături pi aveți în sistemul dvs. conjugat. Mai jos este un exemplu de butadienă. Are 4 electroni pi, așa că umplem mai întâi orbitalii moleculari cei mai mici, doi în fiecare orbital. Prin urmare, cel mai înalt orbital molecular ocupat, sau HOMO, în butadienă este #2. Ca rezultat, cel mai mic obital molecular neocupat, sau LUMO, în butadienă este #3. Putem extinde acest lucru la etilenă și putem vedea că, cu 2 electroni pi, orbitalul molecular #1 este HOMO și orbitalul molecular #2 este LUMO.
Cycloadditions teoria MO
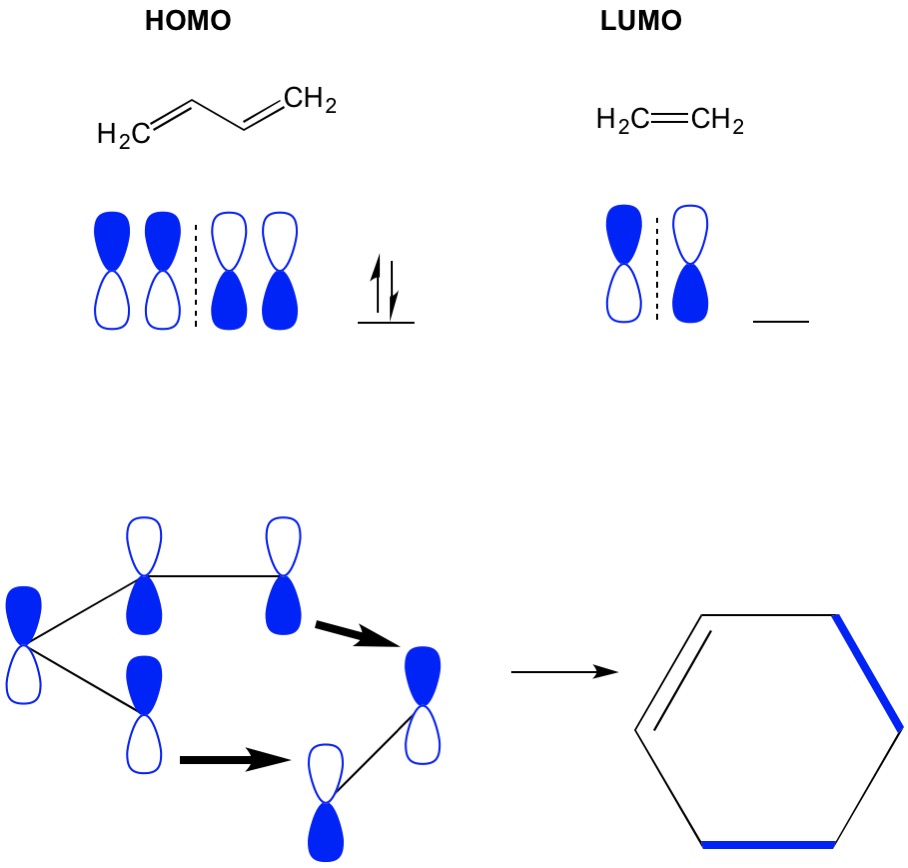
amintiți-vă că reacțiile de cicloadiție descriu formarea de noi legături C-C sigma prin rearanjarea electronilor pi într-un sistem conjugat. Prin urmare, trebuie să folosim orbitalii moleculari ai electronilor pi pentru a conduce reacția. Să luăm reacția butadienei cu etilenă, cea mai simplistă reacție de arin Diels (4+2 cicloadiție). Începem cu cea mai conjugată moleculă, butadienă și examinăm HOMO-ul său. Apoi ne uităm la cea mai puțin conjugată moleculă, etilenă și examinăm LUMO-ul acesteia. De ce? Avem nevoie ca electronii de la un HOMO să curgă de la o moleculă la alta, așa că trebuie să folosim orbitalul LUMO care nu este ocupat pentru acest proces. Vedem că nodurile HOMO și LUMO se aliniază; adică jumătățile deschise și închise ale ganterelor se aliniază. Aceasta duce la o reacție înainte și la formarea produsului, ciclohexen.
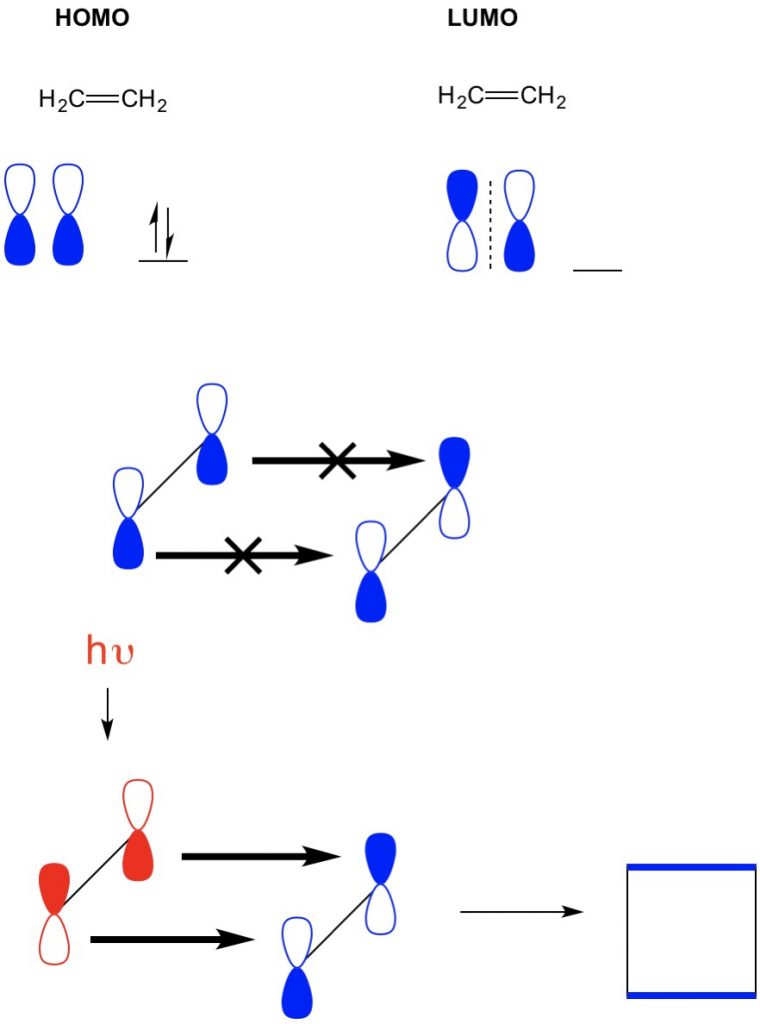
cu toate acestea, într-un alt exemplu în care avem o (2+2 cicloadiție), vedem HOMO și LUMO de etilenă nu se aliniază interzicând astfel reacția. Cu toate acestea, avem capacitatea de a excita electronii de la HOMO la un orbital superior folosind lumina (hv) sau căldură, schimbând astfel HOMO. Analizăm în detaliu acest concept într-un articol anterior. Când facem acest lucru, HOMO-ul etilenei excitate și LUMO-ul etilenei la sol se aliniază și reacția produce ciclobutan.
sperăm că această descriere a ajutat la clarificarea acestor concepte ale teoriei MO. Acesta este un exemplu al expatiațiilor clare și simple pe care le-am pregătit pentru peste 175 de reacții observate frecvent în cursurile Orgo1 și Orgo2. Înscrieți-vă astăzi pentru nevoile dvs. de pregătire a studiului!