Glaucom de joasă tensiune: un oximoron în oftalmologie
Ciro Costagliola, MD1; Luca Agnifili, MD, PhD2; Leonardo Mastropasqua, MD2; Alfonso di Costanzo, MD1 (vezi afilieri autor)
Citat sugerat pentru acest articol: Costagliola c, Agnifili L, Mastropasqua l, di Costanzo A. glaucom de joasă tensiune: un oximoron în oftalmologie. Anterior Dis Cronică 2019; 16: 180534. DOI:http://dx.doi.org/10.5888/pcd16.180534external icon.
termenul glaucom se referă la un grup de afecțiuni oculare caracterizate prin afectarea progresivă a nervului optic și pierderea câmpului vizual (1). Neuropatia optică glaucomatoasă se datorează pierderii progresive a celulelor ganglionare retiniene; presiunea intraoculară crescută (PIO) este un factor de risc major. Pio poate acționa direct, printr-un efect mecanic sau indirect, prin influențarea alimentării cu sânge (2). Factorii care influențează progresia neuropatiei optice glaucomatoase includ vârsta înaintată, stadiul avansat al bolii, Pio mai mare și hemoragiile discului (3). La pacienții cu glaucom primar cu unghi deschis (POAG), rezistența crescută la ieșirea apoasă prin rețeaua trabeculară este principalul vinovat pentru creșterea Pio. Cu toate acestea, în ciuda controlului adecvat al Pio, neuropatia optică glaucomatoasă poate continua să progreseze frecvent. Astfel, sunt recunoscuți factori care nu au legătură cu PIO, cea mai importantă fiind scăderea aportului de sânge la nervul optic (4).alți factori care nu au legătură cu PIO includ toxicitatea glutamatului, stresul oxidativ, autoimunitatea și dereglarea vasculară (3). Glaucomul de joasă tensiune (LTG) este definit ca o formă de glaucom care imită îndeaproape POAG, dar nivelurile IOP sunt în limitele normale, iar patogeneza probabilă este vasculară.
întrebările controversate sunt 1) LTG este o boală pe spectrul POAG (pe partea stângă a distribuției Pio, la cele mai scăzute niveluri)?, 2) este aspectul discului optic secundar hipoperfuziei nervului optic din cauza bolilor vasculare?, sau 3) LTG ar trebui inclus într-un spectru de neuropatii optice congenitale și dobândite care pot simula neuropatia optică glaucomatoasă?
Top
glaucomul de joasă tensiune este o boală pe spectrul glaucomului primar cu unghi deschis?
când în 1857 Albrecht von Graefe a descris o formă de glaucom care manifestă leziuni ale capului nervului optic și un unghi deschis al camerei anterioare, cu IOP în intervalul de referință, tonometria digitală de palpare a fost considerată standardul de aur. Dacă ar fi folosit un tonometru de impresie pentru a măsura IOP, neajunsul major al tonometriei ar fi fost acela că a deplasat atât de mult lichid la contactul cu ochiul, încât citirile măsurate ar fi foarte variabile și inexacte. În schimb, dacă ar fi folosit tonometria de indentare, nu ar fi luat în considerare clasificarea greșită rezultată din prezența unui cornean Central subțire (1). Multe diagnostice de LTG au fost pentru ochi cu cornee subțire și s-au bazat pe valori false scăzute pentru Pio, o constatare care aruncă unele îndoieli cu privire la diagnosticul de LTG (5). În plus, absența Pio crescută trebuie găsită la măsurătorile efectuate de mai multe ori sau în timpul zilei, deoarece Pio prezintă fluctuații diurne și nocturne la subiecții sănătoși și chiar mai mult la pacienții cu POAG sau LTG (6). Pentru variațiile Pio, se pot distinge 3 populații de pacienți cu LTG: pacienți fără fluctuații ale Pio, pacienți cu acrofază diurnă a PIO (creasta sau vârful unui ciclu) și pacienți cu acrofază nocturnă a Pio (7). Pacienții din ultimele 2 categorii trebuie considerați pacienți cu POAG adevărat, mai degrabă decât pacienți cu LTG, la care apare neuropatia optică glaucomatoasă în ciuda Pio normală. Este probabil ca pacienții cu acrofază diurnă sau nocturnă să fi fost înscriși în studii bazate pe teoria mecanică; reducerea Pio poate încetini progresia pierderii câmpului vizual numai la acești pacienți (8). Datele din studiul de tratament cu glaucom de joasă presiune au evidențiat rolul PIO în patogeneza LTG; progresia pierderii câmpului vizual a fost redusă cu 9,1% cu timolol 0,5% și cu 39,1% cu brimonidină 0,2% după 2 ani de tratament (8). Cu toate acestea, în acest studiu, valorile Pio au fost înregistrate exclusiv în timpul zilei. Astfel, nu se cunoaște dacă pacienții cu un câmp vizual mai rău au avut acrofază nocturnă IOP. Alte studii privind LTG asimetric au raportat că ochiul cu PIO mai mare prezintă leziuni glaucomatoase mai mari decât ochiul cu PIO mai mic, ceea ce susține rolul PIO în patogeneză (9). Cu toate acestea, în toate aceste studii clinice Pio a fost măsurată doar în timpul orelor de birou; astfel, comportamentul Pio nocturn nu a fost înregistrat. Un studiu recent în care curbele IOP nychthemerale au fost evaluate cu un senzor telemetric a arătat o acrofază nocturnă cu vârfuri IOP la pacienții cu LTG, deși aceste vârfuri au fost la niveluri semnificativ mai mici decât vârfurile găsite la pacienții cu POAG (7). Acest studiu a raportat că Pio a atins apogeul noaptea la 40% până la 80% dintre pacienții cu glaucom cu tensiune normală, iar modelul la acești pacienți a fost similar cu modelul la pacienții cu POAG. În curbele de 24 de ore, pacienții cu LTG și POAG au avut modele mai pronunțate de Pio seara și noaptea decât dimineața, cu mai multe vârfuri și fluctuații mai mari ale PIO în timpul nopții decât în timpul serii (7). Alți factori pot corobora ipoteza unui stres mecanic primar legat de PIO în LTG, cum ar fi prezența modificărilor căilor de ieșire a umorului apos similare cu cele care apar în POAG (10).
la pacienții în care LTG poate fi considerată o boală pe spectrul POAG, trebuie implementate strategii de diagnostic și terapeutice similare cu cele pentru pacienții cu glaucom hiperbaric, cu ajutorul unui oftalmolog (figura).
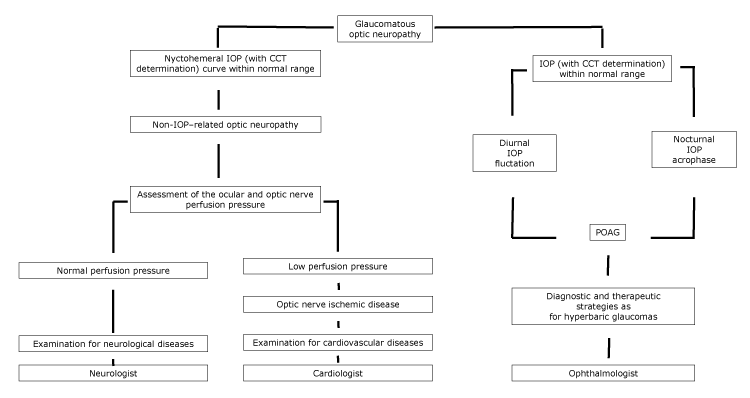
figura.
diagrama propusă a neuropatiei optice, cu trimitere de specialitate, în funcție de caracteristicile Pio nychthemeral. Abrevieri: CCT, grosimea corneei centrale; IOP, presiunea intraoculară; POAG, glaucom primar cu unghi deschis.
Top
este aspectul discului Optic secundar hipoperfuziei nervului Optic din cauza bolilor vasculare?
la pacienții cu LTG și curbe IOP nychtemerale normale, factorii mecanici nu pot fi responsabili de neuropatia optică; pot fi implicați factori independenți de presiune, modificările vasculare putând fi cele mai importante (5). O neuropatie optică asemănătoare glaucomului poate fi observată la pacienții cu antecedente de evenimente cardiovasculare sau cu ateroscleroză cronică sau boli arteriale obstructive (11). Viteza redusă a fluxului sanguin în arterele retrobulbare și în circulația cerebrală, tensiunea arterială diastolică scăzută și diametrul mai mic al vaselor retiniene centrale au fost, de asemenea, observate la pacienții cu LTG (5). La acești pacienți, patogeneza bolii se datorează unei presiuni de perfuzie oculară afectată, legată în principal de dereglarea vasculară primară sau de o disfuncție generalizată a sistemului nervos endotelial sau autonom (5,11). Cu toate acestea, nu este clar dacă acești factori au fost cauza sau rezultatul neuropatiei optice. Din punct de vedere clinic, LTG prezintă o incidență mai mare a hemoragiilor de disc și este mai frecvent asociată cu boli vasculare precum migrenă, apnee obstructivă de somn sau sindromul Raynaud decât cu PIO (5). În cele din urmă, aproximativ jumătate dintre pacienții cu LTG cu boală pre-perimetrică prezintă progresia daunelor în ciuda valorilor normale ale Pio (12). Toate aceste constatări sugerează rolul important al dereglării vasculare.
la pacienții cu boli cardiovasculare, ventuzele cu disc optic pot tinde să nu progreseze dacă cauza principală a neuropatiei optice a fost controlată. Mai mult, pacienții cu LTG pot prezenta atrofie circumpapilară, precum și microinfarcte corticale cerebrale, care sunt semne de ischemie (5). La pacienții în care bolile vasculare induc o hipoperfuzie a nervului optic, trebuie efectuat un examen complet de diagnostic pentru bolile cardiovasculare, cu ajutorul unui cardiolog (figura).
Top
LTG ar trebui inclus într-un spectru de neuropatii optice congenitale și dobândite care pot simula o neuropatie optică Glaucomatoasă?
când au fost excluse cauzele mai frecvente ale cuppingului discului optic, trebuie luată în considerare posibilitatea unei neuropatii optice neurodegenerative. Aceste cazuri sunt cele mai frustrante, deoarece deteriorarea discului optic progresează chiar și după scăderea IOP. Multe neuropatii optice congenitale și dobândite sunt incluse în acest grup de cazuri, iar diferențierea dintre ventuze glaucomatoase și nonglaucomatoase poate fi dificilă chiar și pentru observatorii experimentați (13). Printre formele congenitale de ventuze cu disc optic, megalopapilla, atrofie optică dominantă autosomală și neuropatie optică ereditară Leber ar putea produce o excavare a discului optic simulând neuropatie optică glaucomatoasă.
neuropatiile dobândite pot fi secundare cauzelor inflamatorii, compresive, toxice și traumatice. Nevrita optică poate produce o creștere a raportului cupă-disc care, deși unilaterală, poate fi confundată cu neuropatia optică glaucomatoasă. Leziunile compresive incluzând meningiomul, adenomul hipofizar, craniofaringiomul și anevrismul arterei carotide interne pot duce la cupping asimetric al discului optic și atribuit eronat LTG. Intoxicația cu metanol și etambutol ar putea produce o cupping bilaterală a discului optic similar cu neuropatia optică glaucomatoasă, secundară pierderii axonale. Astfel, atunci când se observă o cupă mărită asimetrică, este necesară o investigație neuro-oftalmologică suplimentară (13).în cele din urmă, printre condițiile care duc la ventuze disc optic, imbatranire are un rol principal. Harju și colab. au descoperit că gradul de ventuze cu disc optic a crescut la participanții sănătoși la studiu mai în vârstă din cauza pierderii fiziologice a fibrelor. Populația lor de studiu a fost adecvată și a reprezentat un set de ochi sănătoși fără glaucom; pe parcursul a 11 ani de urmărire, niciun participant la studiu nu a dezvoltat modificări ale câmpului vizual și nu a fost înregistrată o creștere semnificativă a PIO (14). În acest din urmă caz, trebuie efectuat un examen complet de diagnostic pentru bolile neurologice, cu ajutorul unui neurolog (figura).
Îmbunătățirile tehnicilor de diagnostic fac mai ușoară decât înainte clasificarea ventuze cu disc optic; o descriere a caracteristicilor discului optic combinate cu imagistica stratului de fibre nervoase retiniene și topografia discului optic permite diferențierea între ventuze cu disc optic glaucomatos și nonglaucomatos. Mai mult, o analiză atentă a istoricului pacientului, împreună cu evaluarea morfologică și funcțională a nervului optic, ajută la identificarea tulburărilor.
termenul LTG ar putea fi un oximoron, o amintire nostalgică a trecutului când un diagnostic definit nu era posibil. Folosirea termenului este ca și cum ai folosi cuvântul „febră”atunci când nu există temperatură ridicată sau ai spune festina lente („mai multă grabă, mai puțină viteză”). Termenul LTG poate fi înșelător sau inexact, deoarece se referă la o problemă mecanică a PIO, în timp ce cuppingul discului optic și pierderea câmpului vizual în ochi cu presiune intraoculară normală sunt cauzate de alți factori. Prin urmare, în prezența cuppingului discului optic cu IOP normal, oftalmologii ar trebui să investigheze alte cauze plauzibile ale afectării nervului optic în afară de presiunea intraoculară.
Top
mulțumiri
Acest studiu nu a primit nicio subvenție specifică de la nicio agenție de finanțare din sectoarele public, comercial sau nonprofit.
Top
informații autor
autor corespondent: Luca Agnifili, MD, PhD, Clinica Oftalmologie, Via dei Vestini, 66100, Chieti (CH), Italia. Telefon: + 39-0871-358489. E-mail: [email protected].
Afilieri autor: 1departamentul de Medicină și științe ale sănătății, Universitatea din Molise, Campobasso, Italia. 2departamentul de Medicină și știința îmbătrânirii, Clinica de Oftalmologie, Universitatea G. d’Annunzio of Chieti-Pescara, Chieti, Italy.
Top
- Coleman AL, Miglior S. Risk factors for glaucoma onset and progression. Surv Ophthalmol 2008;53(6, Suppl):S3–10. CrossRefexternal icon PubMedexternal icon
- Costagliola C, dell’Omo R, Romano MR, Rinaldi M, Zeppa L, Parmeggiani F. Pharmacotherapy of intraocular pressure: part I. Parasympathomimetic, sympathomimetic and sympatholytics. Expert Opin Pharmacother 2009;10(16):2663–77. CrossRefexternal icon PubMedexternal icon
- Weinreb RN, Aung T, Medeiros FA. The pathophysiology and treatment of glaucoma: a review. JAMA 2014;311(18):1901–11. CrossRefexternal icon PubMedexternal icon
- Cherecheanu AP, Garhofer G, Schmidl D, Werkmeister R, Schmetterer L. Ocular perfusion pressure and ocular blood flow in glaucoma. Curr Opin Pharmacol 2013;13(1):36–42. CrossRefexternal icon PubMedexternal icon
- Mastropasqua R, Fasanella V, Agnifili L, Fresina M, Di Staso S, Di Gregorio A, et al. Advance in the pathogenesis and treatment of normal-tension glaucoma. Prog Brain Res 2015;221:213–32. CrossRefexternal icon PubMedexternal icon
- Moon Y, Lee JY, Jeong DW, Kim S, Han S, Kook MS. Relationship between nocturnal intraocular pressure elevation and diurnal intraocular pressure level in normal-tension glaucoma patients. Invest Ophthalmol Vis Sci 2015;56(9):5271–9. CrossRefexternal icon PubMedexternal icon
- Agnifili L, Mastropasqua R, Frezzotti P, Fasanella V, Motolese I, Pedrotti E, et al. Circadian intraocular pressure patterns in healthy subjects, primary open angle and normal tension glaucoma patients with a contact lens sensor. Acta Ophthalmol 2015;93(1):e14–21. Icon CrossRefexternal PubMedexternal icon
- De Moraes CG, Liebmann JM, Greenfield DS, Gardiner sk, Ritch R, Krupin T; grupul de studiu pentru tratamentul glaucomului de joasă presiune. Factorii de risc pentru progresia câmpului vizual în studiul de tratament cu glaucom de joasă presiune. Am J Oftalmol 2012; 154 (4):702-11. CrossRefexternal icon PubMedexternal icon
- Cartwright MJ, Anderson Dr. corelarea afectării asimetrice cu presiunea intraoculară asimetrică în glaucomul cu tensiune normală (glaucom cu tensiune joasă). Arch Ophthalmol 1988; 106 (7):898-900. CrossRefexternal icon PubMedexternal icon
- Agnifili L, Carpineto P, Fasanella V, Mastropasqua R, Zappacosta A, Di Staso S, et al. Conjunctival findings in hyperbaric and low-tension glaucoma: an in vivo confocal microscopy study. Acta Ophthalmol 2012;90(2):e132–7. CrossRefexternal icon PubMedexternal icon
- Hayreh SS, Jonas JB. Appearance of the optic disk and retinal nerve fiber layer in atherosclerosis and arterial hypertension: an experimental study in rhesus monkeys. Am J Ophthalmol 2000;130(1):91–6. CrossRefexternal icon PubMedexternal icon
- Collaborative Normal-Tension Glaucoma Study Group. Comparison of glaucomatous progression between untreated patients with normal-tension glaucoma and patients with therapeutically reduced intraocular pressures. Am J Ophthalmol 1998;126(4):487–97. CrossRefexternal icon PubMedexternal icon
- Fraser CL, White AJ, Plant GT, Martin KR. Optic nerve cupping and the neuro-ophthalmologist. J Neuroophthalmol 2013;33(4):377–89. PubMedexternal icon
- Harju M, Kurvinen L, Saari J, Vesti E. Change in optic nerve head topography in healthy volunteers: an 11-year follow-up. Br J Ophthalmol 2011;95(6):818–21. CrossRefexternal icon PubMedexternal icon
Top