Enzime de frontieră perie intestinală mică
Fiziopatologie VIVO
enzime de frontieră perie intestinală mică
etapa finală în digestia carbohidraților și proteinelor dietetice are loc pe fața enterocitelor intestinale mici, în imediata vecinătate a transportorilor care vor transporta zaharurile și aminoacizii rezultați în celulele epiteliale. Enzimele responsabile de această etapă terminală a digestiei nu sunt libere în lumenul intestinal, ci mai degrabă, legate ca proteine membranare integrale în membrana plasmatică a enterocitelor. Membrana plasmatică apicală care adăpostește aceste enzime este compusă din numeroși microvili care se extind din celulă și constituie „marginea periei”. Prin urmare, enzimele încorporate în aceste microvilli sunt denumite enzime de frontieră perie.
densitatea și distribuția enzimelor de frontieră ale periei diferă între diferite segmente ale intestinului subțire și variază adesea în funcție de vârsta animalului. În plus, în unele cazuri, concentrația acestor enzime poate fi modulată prin dietă; de exemplu, cantitatea de enzimă zaharază-izomaltază crește la animalele hrănite cu o dietă bogată în carbohidrați.
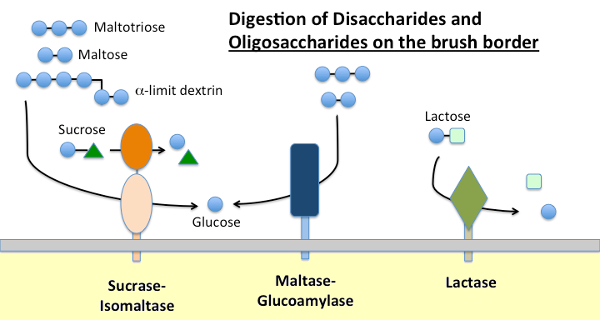
maltază-Glucoamilază și zaharază-izomaltază
amidonul dietetic este digerat de către amilaza-amilază prezentă în secrețiile pancreatice și, la multe specii, în salivă. Amilaza hidrolizează legăturile glicozidice interne-1,4 din amidon pentru a genera maltoză, oligozaharide scurte (de exemplu, maltotrioză) și așa-numitele dextrine limită, care sunt puncte ramificate în amilopectină. Niciuna dintre aceste molecule nu poate fi absorbită de-a lungul epiteliului intestinal subțire și necesită hidroliză suplimentară, în cele din urmă în glucoză.
maltaza-glucoamilaza și zaharaza-izomaltaza sunt enzime strâns legate încorporate în membrana de margine a periei care execută etapele terminale ale digestiei folosind substraturi furnizate de acțiunea amilazei:
- maltaza-glicoamilaza are două situsuri active. Situsul maltazei hidrolizează reziduurile terminale de D-glucoză legate de-1,4 de la maltoză sau maltotrioză, generând reziduuri de D-glucoză legate de-1,4 de la maltoză sau maltotrioză. Situsul glucoamilazei are, de asemenea, acea activitate de hidrolază-1,4, dar și hidrolizează legăturile glicozidice-1,6-1,6 atunci când sunt adiacente unei legături-1,4, eliberând-D-glucoza.
- Zaharaza-izomaltaza are, de asemenea, două situsuri active cu specificități diferite. Situl de zaharază catalizează hidroliza zaharazei în fructoză și glucoză și, de asemenea, este capabilă să hidrolizeze maltoza. Situsul izomaltazei este important ca mecanism major de digerare a legăturilor de tip 1,6-1,6 A dextrinelor limită.
lactaza
lactaza, așa cum sugerează și numele său, este o dizaharidază care hidrolizează lactoza în galactoză și glucoză; în mod formal, este o glicozidază de la un nivel la altul. Lactoza este principalul carbohidrat din lapte, iar lactaza este prezentă abundent în marginea periei intestinale mici a mamiferelor tinere. La majoritatea speciilor, inclusiv la oameni, expresia lactazei scade la scurt timp după înțărcare. La majoritatea oamenilor, această persistență a activității lactazei la vârsta adultă este asociată cu „intoleranța la lactoză”. Diferența dintre persistența lactazei și non-persistența este determinată genetic.
peptidaze
există un număr mare de peptidaze de frontieră perie, care în mod colectiv pot hidroliza diversitatea diversității secvenței de aminoacizi prezente în proteinele dietetice. Clasele majore de peptidaze includ:
- Exopeptidaze care hidrolizează aminoacizii terminali din peptide. Unele dintre aceste enzime au activitate împotriva reziduurilor C-terminale, iar altele lucrează la aminoacizii n-terminali. Activitatea lor produce aminoacizi liberi sau dipeptide. Ca exemplu de specificitate și diversitate enzimatică, aminopeptidaza P hidrolizează aminoacidul n-terminal din di -, tri-și oligopeptide, dar numai dacă sunt legate de prolină, în timp ce aminopeptidaza A catalizează hidroliza aminoacizilor acizi terminali, cum ar fi glutamatul și aspartatul.
- Endopeptidazele scindează lanțurile peptidice intern, producând peptide mai mici de lungime variabilă a lanțului.
- o singură dipeptidază există, de asemenea, ca o enzimă de frontieră perie.
Enteropeptidaza, cunoscută și sub numele de enterokinază, este o altă enzimă de frontieră a periei care are activitatea importantă de catalizare a activării tripsinogenului în tripsină, una dintre proteazele majore din pancreas. Enteropeptidaza este prezentă cel mai abundent în duoden.
lipaze
un număr de lipaze sunt prezente în marginea periei intestinului subțire. Acestea includ fosfolipaza B1, ceramidaza neutră și sfingomielinaza alcalină.