Posts Tagged “MO teoria; cycloaddition; química orgânica; HOMO; LUMO; sistema conjugado”
Um dos mais exigentes conceitos de sistema conjugado reações é de orbitais moleculares medicamentosas, ou MO teoria. O básico a este princípio pode ser difícil de entender, mas será muito informativo na previsão das condições de reação corretas e o resultado da reação se você entendê-los, o que lhe dará uma grande vantagem em futuros testes e exames. Nós na StudyOrgo concebemos uma explicação simples dos fundamentos da teoria MO para ajudá-lo com os seus preparativos de estudo.
princípios da teoria de MO
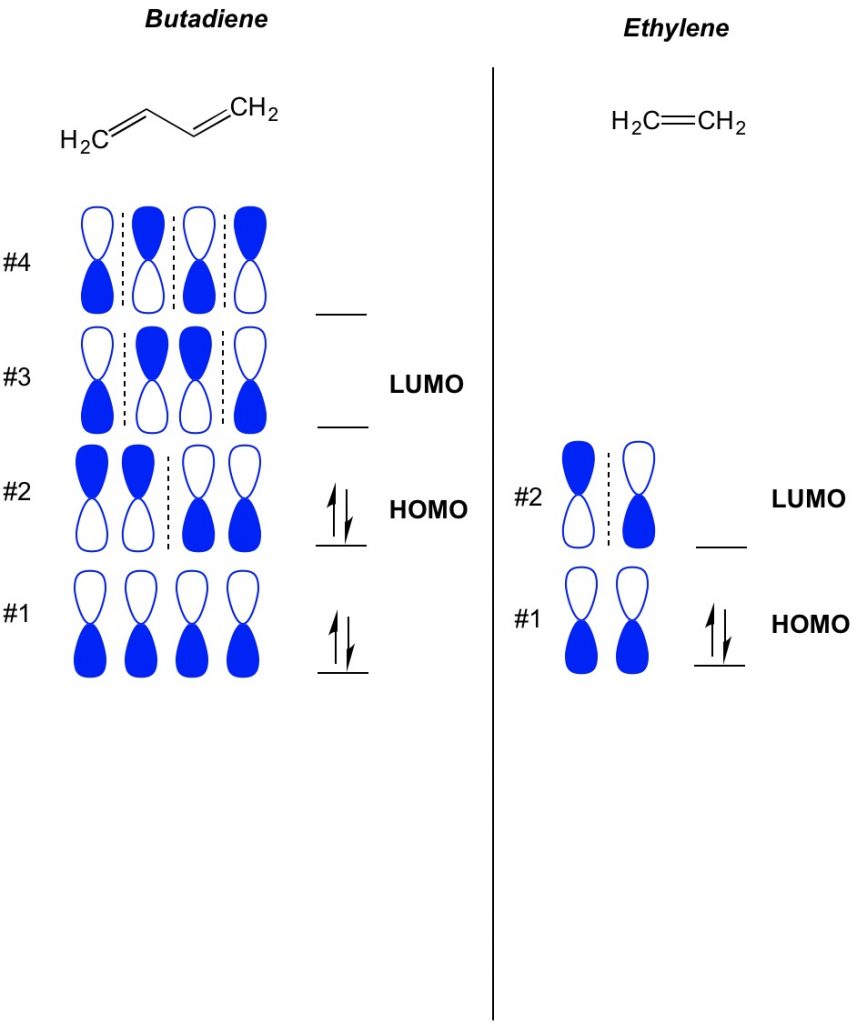
O conceito básico da teoria de MO é descrever os padrões alternados de orbitais que existem em sistemas de ligação de pi. Nós descrevemos a orientação de cada metade do orbital dumbbell centrado em torno de um átomo como sendo ousado ou aberto. Lembrem-se, há laços e orbitais antibonding. Essencialmente, orbitais com menor número de nós (interruptores na orientação do orbital dumbbell que mostramos com a linha tracejada) se comportam mais como orbitais de ligação enquanto orbitais com maior número de nós se comportam como orbitais anti-ligação. Para determinar quais orbitais estão ocupados em sua molécula, basta contar quantas ligações pi você tem em seu sistema conjugado. Abaixo está um exemplo de butadieno. Tem 4 elétrons pi, então preenchemos os orbitais moleculares mais baixos primeiro, dois em cada orbital. Portanto, o orbital molecular mais ocupado, ou HOMO, no butadieno é #2. Como resultado, o menor obital molecular desocupado, ou LUMO, em butadieno é #3. Podemos estender isso para etileno e ver que com 2 elétrons pi, orbital molecular #1 é o HOMO e orbital molecular #2 é o LUMO.
Cicloadditions Mo Theory
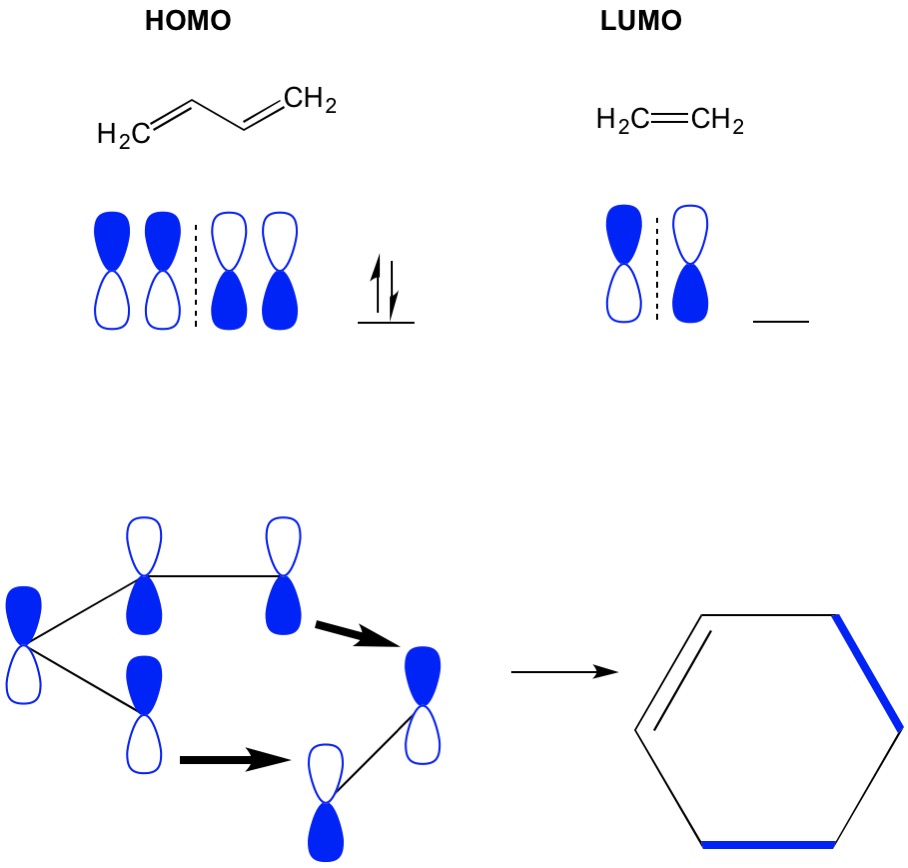
lembre-se que as reações de cicloadição descrevem a formação de novas ligações sigma C-C através do rearranjo dos elétrons pi em um sistema conjugado. Portanto, precisamos usar os orbitais moleculares dos elétrons pi para conduzir a reação. Tomemos a reação de butadieno com etileno, a reação mais simplista de Diels Alder (cicloadição 4+2). Começamos com a molécula mais conjugada, o butadieno, e examinamos o seu HOMO. Então olhamos para a molécula menos conjugada, etileno e examinamos o seu LUMO. Por quê? Precisamos dos elétrons de um HOMO para fluir de uma molécula para outra, então temos que usar a orbital de LUMO que não está ocupada para este processo. Nós vemos que os nós do HOMO e LUMO alinham; que são as metades abertas e fechadas dos halteres alinham. Isto leva a uma reação avançada e formação do produto, ciclo-hexeno.
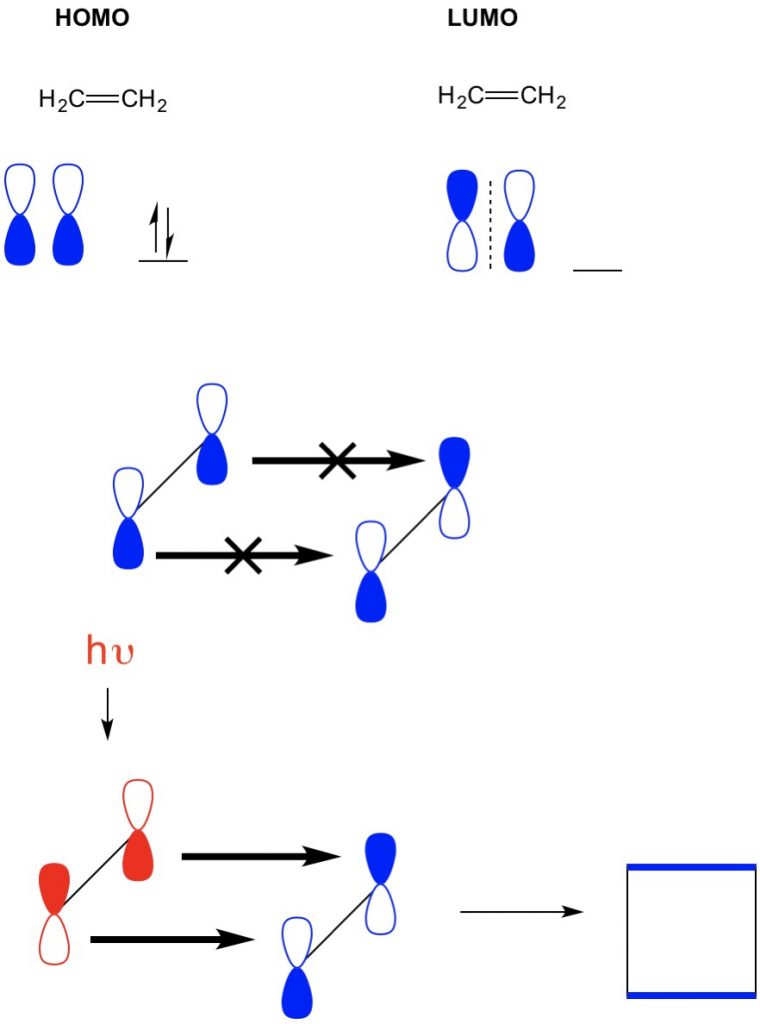
No entanto, em outro exemplo onde temos uma (2+2 cicloadição), vemos que o HOMO e LUMO de etileno não se alinham assim proibindo a reação. No entanto, temos a capacidade de excitar elétrons do HOMO para um orbital mais elevado usando luz (hv) ou calor, mudando assim o HOMO. Revemos este conceito em detalhe num artigo anterior. Quando fazemos isso, o HOMO de etileno excitado e LUMO de etileno do Estado do solo alinha-se e a reação produz ciclobutano.
esperamos que esta descrição tenha ajudado a clarificar estes conceitos da teoria dos MO. Este é um exemplo das expatizações claras e simples que preparamos para mais de 175 reações comumente vistas em cursos de Orgo1 e Orgo2. Inscreva-se hoje para as suas necessidades de preparação de estudo!