Intestino delgado Escova de Fronteira Enzimas
VIVO Fisiopatologia
Pequeno Intestinal Escova de Fronteira Enzimas
A etapa final da digestão da dieta de carboidratos e proteínas ocorre na face das pequenas intestinal enterocytes, nas imediações de transportadores, o que vai de ferry resultante de açúcares e aminoácidos nas células epiteliais. As enzimas responsáveis por esta fase terminal da digestão não estão livres no lúmen intestinal, mas sim, amarradas como proteínas integrais de membrana na membrana plasmática do enterócito. A membrana plasmática apical que cobre estas enzimas é composta por numerosos microvillos que se estendem da célula e constituem a “borda do pincel”. Assim, as enzimas incorporadas nesses microvilli são referidas como enzimas de borda do pincel.
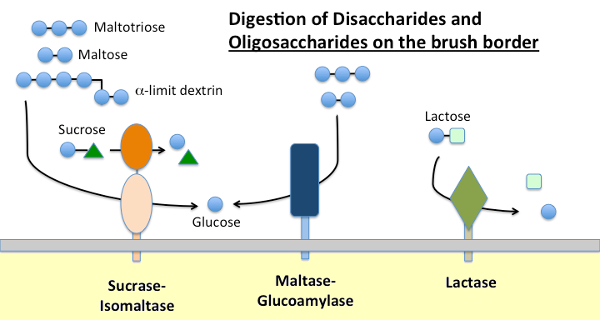
A densidade e distribuição das enzimas de borda dos arbustos difere entre diferentes segmentos do intestino delgado e muitas vezes varia dependendo da Idade do animal. Adicionalmente, em alguns casos, a concentração de tais enzimas pode ser modulada pela dieta; por exemplo, a quantidade de enzima sucrase-isomaltase aumenta em animais alimentados com uma dieta rica em hidratos de carbono.o amido alimentar é digerido pela α-amilase presente nas secreções pancreáticas e, em muitas espécies, na saliva. A amilase hidrolisa as ligações α-1,4 glicosídicas internas em amido para gerar maltose, oligossacáridos curtos (por exemplo, maltotriose) e a chamada dextrina limite, que são pontos de ramificação na amilopectina. Nenhuma destas moléculas pode ser absorvida através do pequeno epitélio intestinal e requer hidrólise adicional, em última análise em glicose.a Maltase-glucoamilase e a sacarase-isomaltase são enzimas estreitamente relacionadas, incorporadas na membrana de contorno do pincel, que executam as fases terminais da digestão utilizando substratos fornecidos pela acção da amilase:
- a Maltase-glicoamilase tem dois locais activos. O sítio da maltase hidrolisa resíduos de D-glucose terminais α-1,4 ligados à maltose ou à maltotriose, gerando α-D-glucose. O local da glucoamilase também tem a actividade da α-1,4 hidrolase, mas também hidrolisa as ligações glicosídicas α-1,6 quando são adjacentes a uma ligação α-1,4, libertando a β-D-glucose.a Sucrase-isomaltase também tem dois locais activos com diferentes especificidades. O local de sucrase catalisa a hidrólise da sucrase em frutose e glicose, e também é capaz de hidrolisar maltose. O sítio da isomaltase é importante como principal mecanismo para digerir as ligações α-1,6 do limite de dextrina.
Lactase
Lactase, como o seu nome indica é uma dissacaridase que hidrolisa a lactose em galactose e glicose; formalmente, é uma β-glicosidase. A Lactose é o principal hidrato de carbono no leite e a lactase está abundantemente presente na pequena fronteira intestinal dos mamíferos jovens. Na maioria das espécies, incluindo os humanos, a expressão da lactase cai pouco depois do desmame. Na maioria dos seres humanos, esta não persistência da actividade da lactase na idade adulta está associada à “intolerância à lactose”. A diferença entre a persistência da lactase e a não persistência é determinada geneticamente.
Peptidases
há um grande número de peptidases de borda de escovas, que colectivamente podem hidrolizar a diversidade de sequências de aminoácidos presentes nas proteínas alimentares. As principais classes de peptidases incluem:
- Exopeptidases que hidrolisam aminoácidos terminais a partir de péptidos. Algumas destas enzimas têm actividade contra resíduos c-terminais e outras trabalham em aminoácidos n-terminais. A sua actividade produz aminoácidos livres ou dipeptídeos. Como exemplo de especificidade e diversidade enzimática, a aminopeptidase P hidrolisa o aminoácido N-terminal de di-, tri – e oligopeptídeos, mas apenas se estiverem ligados à prolina, enquanto a aminopeptidase a cataliza a hidrólise de aminoácidos ácidos terminais como o glutamato e o aspartato.Endopeptidases clivam cadeias peptídicas internas, originando peptídeos mais pequenos de comprimento variável da cadeia.
- uma única dipeptidase também existe como uma enzima de fronteira do pincel.
Enteropeptidase, também conhecida como enterocinase, é outra enzima que tem a actividade importante de catalizar a activiação do tripsinogénio em tripsina, uma das principais proteases do pâncreas. A Enteropeptidase está presente mais abundantemente no duodeno.
Lipases
uma série de lipases estão presentes na borda do pincel do intestino delgado. Estas incluem fosfolipase B1, ceramidase neutra e esfingomielinase alcalina.