Fraqueza nos joelhos: síndrome de Miller Fisher
síndrome de Miller Fisher (MFS), uma variante rara e auto-limitante da síndrome de Guillain-Barré (GBS), é uma síndrome anti-GQ1bIgG que afeta o sistema nervoso periférico e central.1 uma condição neuromuscular aguda polineuropática, MFS causa uma paralisia ascendente com uma tríade de apresentação clássica de oftalmoplegia, ataxia e areflexia. Pesquisadores primeiro descreveram a tríade clínica em 1932.1 Duas décadas mais tarde, o Canadense de avc especialista Charles Miller Fisher foi o primeiro a publicar um relatório, em 1956, que descreveu os achados clínicos e definida a condição como uma forma limitada de GBS.Os sintomas de
ocorrem durante vários dias, frequentemente no inverno e na primavera, tipicamente após uma infecção viral, e os doentes apresentam diplopia como um dos primeiros sintomas. Quando um paciente apresenta sintomas como esotropia intermitente, perseguições horizontais comprometidas e pupilas midráticas fixas, e seu exame neurológico é anormal, é hora de pensar em GBS, especificamente MFS. O caso seguinte ilustra os sinais e sintomas relevantes e reflecte o resultado típico.
história
um homem caucasiano de 27 anos de idade, apresentado na clínica da VA Eye durante os meses de primavera, relatando diplopia binocular aguda iniciada um dia antes. O paciente afirmou que era constante, mas só ocorreu na visualização à distância com objetos deslocados horizontalmente. Não houve dor ocular ou visão turva associada à diplopia. Ele também se queixou de recentes tonturas e dificuldades de equilíbrio. Ele relatou uma infecção sinusal com congestão paranasal significativa que começou uma semana antes da visão dupla. Antecedentes oculares e médicos não eram comuns; o paciente não estava tomando nenhum medicamento e não tinha nenhuma alergia à medicação.
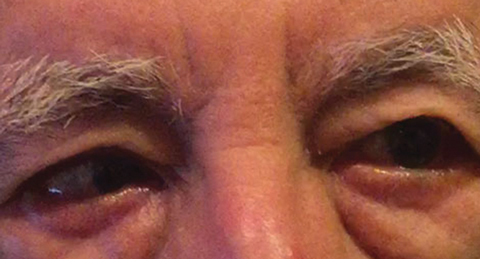
Fig. 1. O diagnóstico diferencial após o exame de base incluiu uma paralisia parcial da VI NC direita, que poderia indicar uma condição vascular, como visto aqui em outro paciente. Clique na imagem para ampliar. Foto: Michael DelGiodice, OD
dados de diagnóstico
no exame de base, acuidades visuais não corrigidas foram 20/20-2 OD e 20/25-2 OS. As pupilas eram 5mm igualmente redondas e reativas à luz sem defeito pupilar. Moutilities Extraocular eram completos, suaves e precisos em ambos os olhos, sem restrições. O teste de cobertura à distância revelou uma intermitente esotropia direita de quatro a seis prismas no olhar primário, ocorrendo aproximadamente 50% do tempo. Realizar um teste de cobertura em near revelou quatro prism diopter esophoria no olhar primário sem tropia.embora não tenha sido realizado neste caso, os clínicos devem cobrir o teste no olhar primário, direito e esquerdo. Em doentes com diplopia, a paralisia do nervo craniano 6 (CN VI) manifesta – se como desvio não-comitante, pior no olhar direito ou esquerdo, dependendo de que lado está a paralisia. Por outro lado, uma Floria descompensadora mostrará um desvio compensador.
efractive error was-0.50 D sphere OD and-0.75 D sphere OS and vision was correctable to 20/20 in each eye. As pressões intra-oculares estavam dentro dos limites normais em ambos os olhos. Os achados do segmento Anterior e posterior não eram comuns nos olhos esquerdo e direito. Os nervos ópticos pareciam saudáveis, com uma proporção entre o copo e o disco de 0,15 em ambos os olhos.os diagnósticos diferenciais incluíram paralisia parcial da CN VI direita (Figura 1), miastenia gravis, um processo de compressão e uma distância de descompensação esoforia causando uma esotropia direita intermitente. O paciente negou qualquer história anterior de diplopia binocular.imagens do cérebro e órbitas foram ordenadas pela clínica ocular para descartar envolvimento cerebral, incluindo uma lesão compressiva. Tomografia computadorizada (TC) scans do cérebro e órbitas foram realizadas e interpretadas pelo neuroradiologista pessoal. A TC foi escolhida em vez de imagiologia por ressonância magnética (MRI) devido ao tempo e disponibilidade; testes e resultados podem ser obtidos no mesmo dia com TC na clínica após horas. Os resultados não foram relevantes, sem sinais de hemorragia intracraniana, lesão compressiva ou enfarte agudo.
CT dos seios paranasais revelou doença paranasal crónica moderada a grave e opacificação completa do seio maxilar direito. Não houve extensão na órbita. O médico de família do doente foi informado dos sintomas do doente, dos resultados do exame oftalmológico e dos resultados da tomografia computadorizada e iniciou o tratamento da sinusite maxilar com uma embalagem de dose oral de azitromicina de cinco dias e instruiu o doente a seguir a clínica oftalmológica.
o doente regressou cinco dias depois de completar o seu curso de azitromicina oral e afirmou não ter registado qualquer melhoria na diplopia à distância; além disso, teve o início de fotofobia significativa e dor periocular em torno de ambos os olhos. O paciente afirmou que seu desequilíbrio de marcha e dificuldades de marcha também estavam piorando. No exame, as acuidades visuais melhor corrigidas permaneceram 20/20 nos olhos direito e esquerdo. As pupilas foram dilatadas a 8,5 mm sem reactividade à luz em qualquer dos olhos (Figura 2). Moutilities Extraocular revelou restrição lateral com dor sobre o movimento no olho direito e restrição medial com dor sobre o movimento no olho esquerdo consistente com uma paralisia do olhar direito (Figura 3). As atividades horizontais e verticais eram sacádicas com movimentos imprecisos e irregulares. Os resultados do segmento Anterior e posterior permaneceram normais.os diagnósticos diferenciais após exame oftalmológico incluíram oftalmoplegia internuclear esquerda, paralisia do olhar direito e paralisia do olhar direito com oftalmoplegia internuclear esquerda, o que poderia explicar os achados de motilidade extraocular. Outros diferenciais incluem uma lesão do mesencéfalo ou miastenia gravis. Os diagnósticos diferenciais para dilatação da pupila incluem paralisia do terceiro nervo (CN III), trauma e dilatação farmacológica. O paciente não teve quaisquer outros resultados consistentes com uma paralisia do terceiro nervo e negou trauma ou exposição a agentes farmacológicos. o doente foi encaminhado para neurologia para avaliação posterior. O exame neurológico relatou que o doente estava completamente alerta e orientado sem perda de sensação facial. O doente exibiu ataxia ligeira com dificuldade em andar em conjunto e de pé a partir de uma posição de ocupação. Fraqueza Proximal nas extremidades superior e inferior e reflexos anormais. Todas as modalidades sensoriais estavam intactas. A ressonância magnética e a angiografia por ressonância magnética (MRA) do cérebro e órbitas eram pouco comuns. A proteína do líquido cefalorraquidiano foi elevada a 75mg / dL (intervalo de referência: 15mg/dL a 45mg/dL) sem outras anomalias. O teste do eletromiograma não foi notável e não mostrou anomalias na condução do nervo da coluna para os pés e mãos.
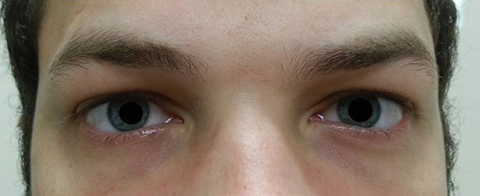
Fig. 2. As Pupilas do paciente foram dilatadas 8,5 mm sem reactividade nos olhos direito ou esquerdo. Clique na imagem para ampliar.
diagnóstico
o doente apresentou sintomas agudos de diplopia, ataxia e areflexia. Devido à esotropia direita intermitente, a actividades horizontais deficientes, pupila midrática fixa, ataxia ligeira e reflexos anormais no exame neurológico e proteína elevada do líquido cefalorraquidiano, o diagnóstico MFS foi feito. O paciente foi internado no hospital para monitorizar outras complicações. Foi fornecido um adesivo ocular ao doente para cobrir o olho direito, conforme necessário para a diplopia.não existem actualmente critérios de diagnóstico publicados para a síndrome de Miller Fisher. O diagnóstico é geralmente feito através da apresentação da tríade clínica, juntamente com imagiologia e estudos do líquido cefalorraquidiano. A ressonância magnética é tipicamente normal na condição, embora alguns estudos tenham mostrado lesões centrais no mesencéfalo, pons e medulla inferior. Estudos electrofisiológicos mostram condução sensorial periférica reduzida ou anormal.A proteína do líquido cefalorraquidiano é muitas vezes elevada sem quaisquer outros resultados anormais. Num estudo de referência, 64,4% dos doentes com MFS apresentaram elevada proteína do fluido espinhal.Um teste de anticorpos anti-Gq1b IgG positivo permite um diagnóstico definitivo. Num estudo, o anticorpo IgG anti-GQ1b esteve presente em até 95% dos doentes com a condição e ausente nos controlos.3
o neurologista diagnosticou o doente com MFS com base na tríade clínica de oftalmoplegia, ataxia e areflexia, uma IRM normal e MRA do cérebro e proteína do fluido cerebrospinal elevada. Assim, neste caso, não foram realizados testes de anticorpos anti-GQ1b IgG.várias características clínicas da MFS também são observadas na síndrome de Guillain-Barré e na encefalite cerebral de Bickerstaff, tornando o diagnóstico desafiador. Doentes com apenas Guillain-Barré apresentam fraqueza nos membros, perda sensorial, neuropatia craniana e areflexia sem manifestações oftalmológicas. Doentes com encefalite do tronco cerebral de Bickerstaff apresentam normalmente oftalmoplegia, ataxia, hiper-reflexia e uma consciência perturbada. Uma vez que vários sintomas e sinais estão presentes em todas as três condições, o teste de título de anticorpos IgG anti-GQ1b é útil para um diagnóstico mais definitivo. O anticorpo IgG Anti-GQ1b é positivo numa grande maioria dos doentes com síndrome de Miller Fisher, em comparação com 66% na encefalite cerebral de Bickerstaff e 26% nos doentes com síndrome de Guillain-Barré.16
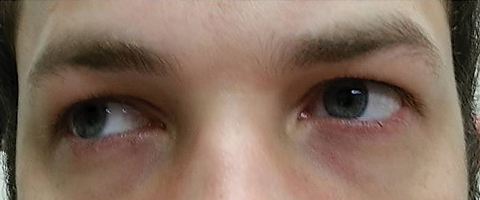
Fig. 3. O moutilities Extraocular revelou restrição no dextroversion. Clique na imagem para ampliar.
tratamento e acompanhamento
o paciente foi avaliado no dia após a admissão, quando ele afirmou que não experimentou alterações visuais ou melhoria no equilíbrio. A diplopia Binocular ainda era constante; portanto, o olho direito permaneceu remendado. Dor ocular com olhares distantes e movimentos oculares rápidos ainda estavam presentes. Em exames limitados, as acuidades visuais melhor corrigidas permaneceram 20/20 nos olhos direito e esquerdo. Pupilas dilatadas às 8.0mm em ambos os olhos com reactividade mínima, que foi ligeiramente melhorada a partir do dia anterior. A visão colorida era normal nos olhos direito e esquerdo. Moutilities extraoculares estavam cheios em todos os quadrantes com dor ainda presente em Far horizontal gazes. Perseguições horizontais permaneceram sacádicas com movimentos de carne seca e endpoint nistagmo. Os nervos ópticos pareciam saudáveis com margens distintas e uma relação entre o copo e o disco de 0,15 em ambos os olhos.dois dias depois, o paciente declarou uma melhoria em todos os sintomas e que seus olhos “se sentem melhor hoje do que em um tempo”.”Dor ocular e diplopia binocular foram ambas resolvidas. As acuidades visuais permaneceram 20/20 nos olhos direito e esquerdo. Os tamanhos das pupilas eram de 7, 5 mm em escuro e 7, 0 mm em luz, com melhores respostas diretas e consensuais em ambos os olhos. O moutilities Extraocular estava cheio em todos os quadrantes sem dor nos olhos. Perseguições horizontais permaneceram sacádicas com movimentos de carne seca e endpoint nistagmo. O exame neurológico revelou reflexos anormais, que permaneceram estáveis. As opções de tratamento para MFS incluem plasmaférese e imunoglobulina IgG intravenosa (IV), mas estas foram retidas devido à melhoria na oftalmoplegia e ataxia.quatro dias depois, o paciente relatou que todos os sintomas ainda estavam melhorando, com alguma dificuldade de foco e rastreamento durante o uso do computador. O saldo foi 80% resolvido e houve poucas ocorrências de diplopia à distância. As acuidades permaneceram 20/20 OU. As pupilas estavam 5,5 mm na escuridão e 4,0 mm na luz com 3 + respostas diretas e consensuais OU. O moutilities Extraocular estava cheio em todos os quadrantes sem dor nos olhos. As atividades horizontais foram melhoradas, sem movimentos sacádicos. A acomodação Monocular era normal, que foi medida 8.5 e 9 prism diopters OD e OS, respectivamente.
uma semana depois, o doente relatou que a sua visão voltou ao normal sem diplopia e dificuldades ligeiras de focalização e seguimento. O equilíbrio foi 100% resolvido. As acuidades visuais permaneceram 20/20 nos olhos direito e esquerdo. Os tamanhos das pupilas eram de 5, 5 mm em escuro, 4, 0 mm em luz com 4+ respostas directas e consensuais OU. O moutilities Extraocular estava cheio em todos os quadrantes sem dor nos olhos. As atividades horizontais melhoraram sem movimentos sacádicos observados. A saúde Ocular era normal. o tratamento com
foi suspenso devido à resolução de oftalmoplegia e ataxia com areflexia estável. A recuperação total da optalmoplegia e ataxia levou duas semanas. A gestão incluiu monitorização cuidadosa e acompanhamento em quatro semanas; o doente foi aconselhado a regressar mais cedo se algum dos seus sintomas regressasse.em estudos de MFS bem descritos, todos os doentes apresentaram a tríade clínica de oftalmoplegia, ataxia e areflexia.4,5 início dos sintomas normalmente ocorrem ao longo de vários dias, e os pacientes sofrem uma infecção viral uma a quatro semanas antes do início dos sintomas clínicos.4,5 de acordo com um estudo de 50 doentes com esta doença, o intervalo médio entre o início da infecção e o desenvolvimento de sintomas neurológicos é de oito dias.4 outros sinais de MFS incluem fala arrastada, dificuldade de engolir e uma expressão facial anormal com uma incapacidade de sorrir ou assobiar.características oftalmológicas. Os praticantes devem estar atentos à midríase, à retracção da tampa, ao fecho do ângulo agudo e à diplopia secundária às palsias nervosas que afectam a CN III, IV e VI. 3,8,10,22,24 Diplopia é o sintoma oftalmológico mais comum relatado em muitos estudos da MFS.8, 16, 25, 26, 27 Diplopia é também o sintoma inicial notificado em 38, 6% dos 223 doentes num estudo histórico e 65% dos 466 doentes num segundo estudo.8, 27 no segundo estudo, 100% dos doentes apresentaram oftalmoplegia externa, enquanto que a oftalmoplegia interna esteve presente em 35% dos doentes.Oftalmoplegia externa refere-se à diminuição dos músculos extraoculares externos. Oftalmoplegia interna refere-se à diminuição do esfíncter pupilar e do músculo ciliar. Oftalmoplegia completa afeta ambos os músculos externos e internos.num estudo retrospectivo de 19 doentes com MFS, todos apresentaram uma ou mais palsias nervosas que afectam os músculos extraoculares.Outros estudos mostram que os doentes com MFS podem ter múltiplas palsias do nervo craniano, que podem manifestar-se bilateralmente.22,24,25 uma constatação comum encontrada entre distúrbios positivos IgG anti-GQ1b é o déficit de abdução consistente com uma paralisia unilateral ou bilateral da NC VI.26,28 oftalmoplegia interna causa midríase da pupila, onde a constrição da pupila à luz e / ou perto da estimulação pode variar de mínimo a ausente.8, 26 num relatório, a midríase estava presente em 42% dos pacientes. O envolvimento da CN VII ocorreu em aproximadamente 45,7% dos pacientes com MFS causando fraqueza facial, incapacidade de sorrir ou assobiar.Ataxia. A causa desta característica clínica na MFS não é totalmente compreendida. Existe um Debate sobre se a ataxia é causada por disfunção centralmente no cerebelo ou perifericamente. A primeira hipótese, proposta pelo Dr. Fisher, postulou o envolvimento de neurônios aferentes.2 Isto foi apoiado por um segundo estudo décadas mais tarde, que mostrou anormalidades de fibras Ia-aferentes em MFS.O envolvimento anormal do nervo periférico também foi proposto com um desfasamento entre a entrada proprioceptiva dos fusos musculares e a informação cinestética dos receptores articulares.12
também houve evidências de que a ataxia se origina no cerebelo. Verificou-se uma predominância do anticorpo IgG anti-GQ1b no cerebelo utilizando coloração imunocitoquímica do cerebelo humano e confirmou-se ainda mais com estudos western blot, que mostraram aumento do anticorpo IgG anti-GQ1b em doentes com MFS em comparação com o controlo, embora o mecanismo de envolvimento cerebelar não tenha sido estudado.13,14 em 2015, pesquisadores publicaram um relatório de caso de um paciente MFS que foi submetido a ressonância magnética. Houve uma razão N-acetilaspartato/creatina reduzida, sugerindo disfunção cerebelar, que voltou ao normal 2, 5 meses após a recuperação.23
Areflexia. Esta característica clínica, juntamente com a depressão dos reflexos dos tendões profundos, é um sinal de envolvimento do sistema nervoso periférico na MFS. Estudos electrofisiológicos validaram a condução anormal do nervo periférico em GBS e MFS.Num estudo, 81, 6% dos casos de MFS apresentaram arefexia.Outro estudo de referência mostrou que todos os doentes experimentaram areflexia, que ainda estava presente seis meses após o início.4
quão comum é o MFS?os dados epidemiológicos sobre a síndrome de Miller Fisher são limitados. A incidência de MFS é bastante rara, ocorrendo em 0,09 por 100.000 pessoas anualmente.3 MFS ocorre mais frequentemente em doentes com síndrome de Guillain-Barré, de 3% a 25%.46,7 esta associação ocorre mais em pacientes de ascendência do Extremo Oriente, sugerindo um possível componente genético para MFS. A idade média de início é de 43 anos, com um intervalo de 13 a 78,5 MFS afeta homens duas vezes mais do que mulheres com uma razão de dois a 1,03,5 MFS ocorre mais no inverno e na primavera.5, 6,8 a causa exacta da predilecção sazonal não foi determinada, mas está provavelmente associada à natureza pós-infecciosa da doença, uma vez que se verificou que as infecções bacterianas e virais desencadeiam uma resposta auto-imune, causando a produção do anticorpo IgG anti-GQ1b em MFS.
Fisiopatologia
a fisiopatologia da síndrome de Miller Fisher não é bem compreendida; no entanto, existem várias hipóteses de estudos imunológicos e histológicos. É bem conhecido que a condição está dentro do espectro de síndromes de anticorpos IgG anti-GQ1b, juntamente com síndrome de Guillain-Barré e encefalite cerebral de Bickerstaff.
o gq1b gangliosido é um grupo de lípidos complexos envolvidos no sistema nervoso central e periférico. O GQ1b é um componente da estrutura da membrana plasmática nos nervos cranianos que abastecem os músculos extraoculares e está envolvido na função celular na junção neuromuscular pré-sináptica.
um mecanismo auto-imune a partir de uma infecção anterior desencadeante irá produzir o anticorpo IgG anti-GQ1b, que danifica a função ganglioside GQ1b, causando desmielinização. Estudos histológicos demonstraram desmielinização e tumefacção axonal nos nervos cranianos periféricos e oculomotores.O anticorpo anti-GQ1bIgG está ausente em doentes saudáveis, mas é positivo em mais de 90% dos doentes com MFS.Verificou-se que 16, 25
infecções bacterianas e virais desencadeiam uma resposta auto-imune, causando a produção do anticorpo IgG anti-GQ 1b. Os seguintes agentes infecciosos que têm sido associados com MFS incluem pneumonia mycoplasma, HIV, Campylobacter jejuni, Hemophilus influenza, Helicobacter pylori e vírus Epstein-Barr.4, 16 num relatório que analisou 466 doentes com MFS, 90% tinham uma doença prévia, incluindo infecção respiratória superior, diarreia ou ambos.A síndrome de Miller Fisher é uma doença auto-limitante e apresenta um prognóstico globalmente positivo. Os sintomas geralmente melhoram após algumas semanas com recuperação total tipicamente ocorrendo em dois a três meses. Num estudo, a recuperação começou com uma mediana de 13 dias desde o início dos sintomas, e a resolução completa da oftalmoplegia e ataxia ocorreu em seis meses.Verificou-se que ocorreram 4,5 recidivas em menos de 3% dos casos.4,5
embora MFS seja tipicamente auto-limitante, complicações sistêmicas têm sido associadas com a condição. As infecções respiratórias superiores foram encontradas em 56% a 76% dos doentes com MFS, o que pode progredir para uma insuficiência respiratória que requer ventilação mecânica.Outras complicações graves raras incluem cardiomiopatia, acidose láctica e coma.3. 20
as opções de tratamento para MFS incluem plasmaferese, imunoglobulina IgG IV e monitorização sem tratamento. Os investigadores postulam que a plasmaférese e a IgG IV podem ser eficazes para acelerar o tempo de resolução, uma vez que o anticorpo Gq1b é IgG na classe e a semi-vida da IgG é de aproximadamente 21 dias, o que é mais longo do que as semi-vidas de cinco a seis dias da IgM e IgA.Contudo, não foram realizados estudos aleatorizados, em dupla ocultação, controlados com placebo, que investigassem estes tratamentos.
Um estudo retrospectivo não mostrou plasmaferese alterou a possibilidade de recuperação total e o tempo para resolver ataxia e oftalmoplegia; além disso, o intervalo desde o início até ao início do tratamento com plasmaferese não afectou o tempo até à resolução ou a gravidade dos sintomas no início. No entanto, um relatório de caso indica que a plasmaferese é indicada quando há ataxia profunda, insuficiência motora e respiratória.Os doentes devem ser cuidadosamente monitorizados quanto ao risco de desenvolverem complicações sistémicas graves, tais como insuficiência respiratória superior. Estudos não mostram melhoria significativa no tempo de recuperação com IgG IV ou tratamento de plasmaferese em MFS, por isso a monitorização pode ser a melhor opção do praticante. apesar de rara, a condição não precisa de ser diagnosticada. Ao reconhecer as principais características clínicas, os profissionais podem revelar a causa dos sintomas do paciente e ganhar confiança em uma recuperação completa. Wang e Cantrell são optometristas do Centro Médico Orlando VA. O Dr. Cali é optometrista da Clínica de veteranos de Lee County. Os autores desejam agradecer a Joseph Miller, OD, Paul Gruosso, OD, e Vanessa Santos, OD, pela ajuda com este manuscrito.
1. Collier J. Peripheral neuritis: The Morisa lectures. Edinburgh Med J. 1932: 39: 601-18.
2. Fisher M. uma variante incomum da polineurite idiopática aguda (síndrome oftalmoplegia, ataxia e areflexia). N Eng J Med. 1956:255:57-65.
3. Lo YL, et al. Espectro clínico e imunológico da síndrome de Miller Fisher. Nervo Muscular. 2007:36(5):615-27.
4. Mori M, Kuwabara s, Fukutake T, et al. Características clínicas e prognóstico da síndrome de Miller Fisher. Neurologia. 2001:56(8): 1105-6.
5. Mori M, Kuwabara s, Fukutake T, et al. Plasmapharesis and Miller Fisher syndrome: Analysis of 50 consecutive cases. Neurol Neurosurg Psych. 2002:72:680.
6. Yuan CL, Wang YJ, Tsai CP. Síndrome de Miller Fisher: um estudo retrospectivo baseado em hospital. Euro J Neurol. 2000:44(2):79-85.
7. Cheng BC, Chang WN, Chang CS et al. Síndrome de Guillain-Barré no sul de Taiwan: Características clínicas, factores de prognóstico e resultados terapêuticos. Euro J Neurol. 2003:10 (6):655-62.
8. Berlit P, Rakicky J. síndrome de Miller Fisher. Review of literature. J neuro-oftalmologia clínica. 1992:12:57-63.
9. Lyu RK, Tang LM, Cheng SY, et al. Síndrome de Guillain-Barré em Taiwan: um estudo clínico com 167 doentes. Neurol Neurosurg Psych. 1997:63:494-500.
10. Tatsomoto M, Odaka m, Hirata K, Yuki N. isolado abduzens paralisia como uma variante regional da síndrome de Guillain-Barré. J Neurol Sci. 2006:243:35-8.
11. Weiss JA, JC Branco. Correlação da 1a condução aferente com ataxia da síndrome de Fisher. Nervo Muscular. 1986:9:327-32.
12. Das P, Biswash S, et al. Miller Fisher variant of guillain-barré syndrome: A case report and clinical review. Bangabandhu Sheikh Mujib Medical Univer J. 2012:5 (1): 69-71
13. Kornberg AJ, Pestronk a, Blume GM, et al. Coloração selectiva da camada molecular cerebelar por IgG sérica de Miller Fisher e síndromes relacionadas. Neurologia. 1996:47:1317-20.
14. Inoue N, Koh C, Iwahashi T. Detection of serum anticerebellar antibodies in patients with Miller Fisher Syndrome. Euro J Neurol. 1999:42:230-4.
15. Barontini F, Di Lollo S, Maurri S, Lambruschini P. Localization of the patological process in Miller Fisher Syndrome. Itália J Neurol Sci. 1992:13:221-5.
16. Koga m, Yuki N, Takahashi m, et al. Associação estreita dos anticorpos anti-gangliósidos IgA com a infecção antecedente de Campylobacter jejuni em síndromes de Guillain-Barré e Fisher. J Neuroimmunol. 2003:141:112-7.
17. Guiloff RJ. Condução nervosa periférica na síndrome de Miller Fisher. Neurol Neurosurg Psychiat. 1977:40:801-7.
18. Chikakiya H, Kunishige M, Yoshino H, et al. Neuropatia motora e sensorial retardada num doente com encefalite cerebral. J Neurol Sci. 2005:234:105-8.
19. Arakata Y, Yoshimuro M, Kobayashi S, et al. O uso de imunoglobulina intravenosa na síndrome de Miller Fisher. Brain Develop J. 1993: 15:231-3.
20. Matsumoto H, Kobayashi o, Tamura K, et al. Síndrome de Miller Fisher com coma transitório: comparação com a encefalite cerebral de bickerstaff. Brain Develop J. 2002: 24: 98-101.
21. Yeh JH, Chen WH, Chen JR, et al. Síndrome de Miller Fisher com envolvimento central: tratamento bem sucedido com plasmaferese. Therap Afheresis Dialisy J. 1999: 3: 69-71.
22. Papanikolaou T, Cath G, Boothman B, et al. Case report: acute bilateral ofthalmoparesis with pupilary areflexical mydriasis in Miller-Fisher syndrome treated with intravenous immunoglobulin. J Oftalmol. 2010; artigo ID n. o 291840.
23. Sandler RD, Hoggard N, Hadjivassiliou M. Miller-Fisher syndrome: a ataxia é central ou periférica? Cerebelo Ataxias. 2015:2:3.
24. Ejma M, Waliszewska-Prosół m, Hofman A, et al. Síndrome subaguda progressiva de Miller-fisher tratado com sucesso com plasmaferese. Neurol Neurosurg Polaco. 2015;49(2):137-8.
25. San-Juan OD, Martínez-Herrera JF, Moreno García J, et al. Síndrome de Miller Fisher: 10 anos de experiência num centro de terceiro nível. Euro Neurol. 2009; 62: 149-54
26. Snyder LA, Rismondo V, Miller NR. A variante Fisher da síndrome de Guillain-Barré (síndrome de Fisher). J Neurooftalmol. 2009 Dec;29 (4): 312-24.
27. Ito M, Kuwabara s, Odaka M, et al. A encefalite do tronco cerebral de Bickerstaff e a síndrome de fisher formam um espectro contínuo: análise clínica de 581 casos. J Neurol. 2008;255:674-82.
28. Yuki N. paresia aguda de músculos extraoculares associados com anticorpos anti-Gq1b IgG. Ann Neurol 1996; 39: 668-72.