Comum de Iões de Efeito
Ciências > Química > Físico-Química > Equilíbrios Iônicos > Comum de Iões de Efeito
neste artigo, vamos estudar o comum de iões de efeito e suas aplicações.
O fenômeno em que o grau de dissociação de qualquer eletrólito fraco é suprimida pela adição de uma pequena quantidade de forte eletrólito contendo um íon comum é chamado de um íon comum efeito.exemplo-1: (dissociação de um fracote)
ionização do ácido acético eletrolítico fraco (CH3COOH)é suprimida adicionando acetato de sódio eletrolítico forte (CH3COONa) contendo ião acetato comum (CH3COO–)
explicação:
suponha, um ácido acético eletrolítico (CH3COOH) misturado com água. Se dissocia e um equilíbrio existsas segue,
CH3COOH(aq) ⇌CH3COO–(aq) + H+(aq)
aplicando a lei de ação de massa,
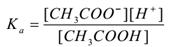
Onde ‘Ka’ é a constante de dissociação do ácido.
Se uma pequena quantidade de um eletrólito forte, como acetato de sódio (CH3COONa) é adicionado a uma solução aquosa de CH3COOH, torna-se dissociados e de equilíbrio existe, como
CH3COONa(aq) → CH3COO–(aq) + Na+(aq)
Aqui CH3COO– íons são comuns, portanto, a sua concentração aumenta. De acordo com o princípio de Le-Chatelier, o equilíbrio muda para a esquerda. Para manter o valor de Ka constante, a concentração de moléculas de CH3COOH é aumentada. Desta forma, a ionização de CH3COOH é suprimida adicionando CH3COONa. Assim o pH da solução aumenta.Exemplo-2: (dissociação de uma base fraca):
ionização de hidróxido de amónio eletrolítico fraco (NH4OH) é suprimida adicionando cloreto de amónio eletrolítico forte (NH4Cl) contendo ião amónio comum (NH4+)
explicação:
suponha que um hidróxido de amónio electrolítico (NH4OH) é tratado com água. Se dissocia e um equilíbrio existsas segue,
NH4OH(aq) ⇌ NH4+(aq) + OH–(aq)
aplicando a lei de ação de massa,
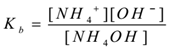
Onde ‘Kb ís constante de dissociação da base.
Se uma pequena quantidade de um eletrólito forte, como cloreto de Amónio (NH4Cl) é adicionado a uma solução aquosa de NH4OH, torna-se dissociados e de equilíbrio existe, como
NH4Cl(aq) → NH4+(aq) + Cl–(aq)
Aqui NH4+ íons são comuns, portanto, a sua concentração aumenta. De acordo com o princípio de Le-Chatelier, o equilíbrio muda para a esquerda. Para manter o valor de Kb constante, a concentração de moléculas NH4OH é aumentada. Desta forma, a ionização de NH4OH é suprimida pela adição de NH4Cl. Assim o pH da solução diminui.aplicações de efeito iónico comum:purificação do sal comum: princípio:
a adição de ião comum a uma solução saturada de sal provoca a precipitação do sal. Quando o produto iónico excede o produto da solubilidade, procede-se à precipitação.
processo e explicação:
uma solução saturada de sal comum, isenta de impurezas suspensas é tomada e o gás HCl é atravessado por ela. Em um saturatedsolution de impuros Nacl, o equilíbrio existe, como se segue,
NaCl(aq) → Na+(aq) + Cl–(aq)
Se puros HCI gás é passado através desta solução, beingstrong eletrólito, ele dissocia-se quase completamente e o equilíbrio existe,
HCl(aq) → H+(aq) + Cl–(aq)
Agora, o Cl– é um íon comum. A concentração de íons (íons comuns) é aumentada. De acordo com o princípio de toLe-Chatelier, o equilíbrio muda para a esquerda. A dissociação de NaCI é suprimida e a NaCI pura é precipitada como solidsalt. Desta forma, a NaCI pura pode ser precipitada através da passagem de gás HCI em solução insaturada de NaCI impura.
salga de sabão:
princípio:
a adição de ião comum a uma solução saturada de sal causa a precipitação de sal. Quando o produto iónico excede o produto da solubilidade, procede-se à precipitação.o sabão é sal de sódio de ácidos gordos superiores(RCOONa). É preparado por hidrólise de óleos com NaOH. Em saturatedsoap solução, existe um equilíbrio,
ROONa(aq) → RCOO–(aq) + Na+(aq)
Se uma pequena quantidade de NaCl é adicionado à saturada solução de sabão, é dissociado, como
NaCl(aq) → Na+(aq) + Cl–(aq)
a Concentração de Na+ íons (íon comum) aumenta. Devido ao efeito iônico comum, a dissociação do sabão é diminuída e o sabão se precipita e, em seguida, pode ser facilmente removido da solução de sabão. Este processo de obtenção de sabão sólido a partir de solução de sabão, adicionando sal como NaCI é chamado salgando fora de sabão.