Posts Etiquetados «teoría MO; cicloadición; química orgánica; HOMO; LUMO; sistema conjugado»
Uno de los conceptos más desafiantes en las reacciones de sistemas conjugados es la interacción orbital molecular, o teoría MO. Los conceptos básicos de este principio pueden ser difíciles de comprender, pero serán muy informativos para predecir las condiciones de reacción correctas y el resultado de la reacción si las entiendes, lo que te dará una gran ventaja en futuros exámenes y pruebas. En StudyOrgo hemos ideado una explicación simple de los fundamentos de la teoría MO para ayudarlo con sus preparativos de estudio.
Principios de la Teoría MO
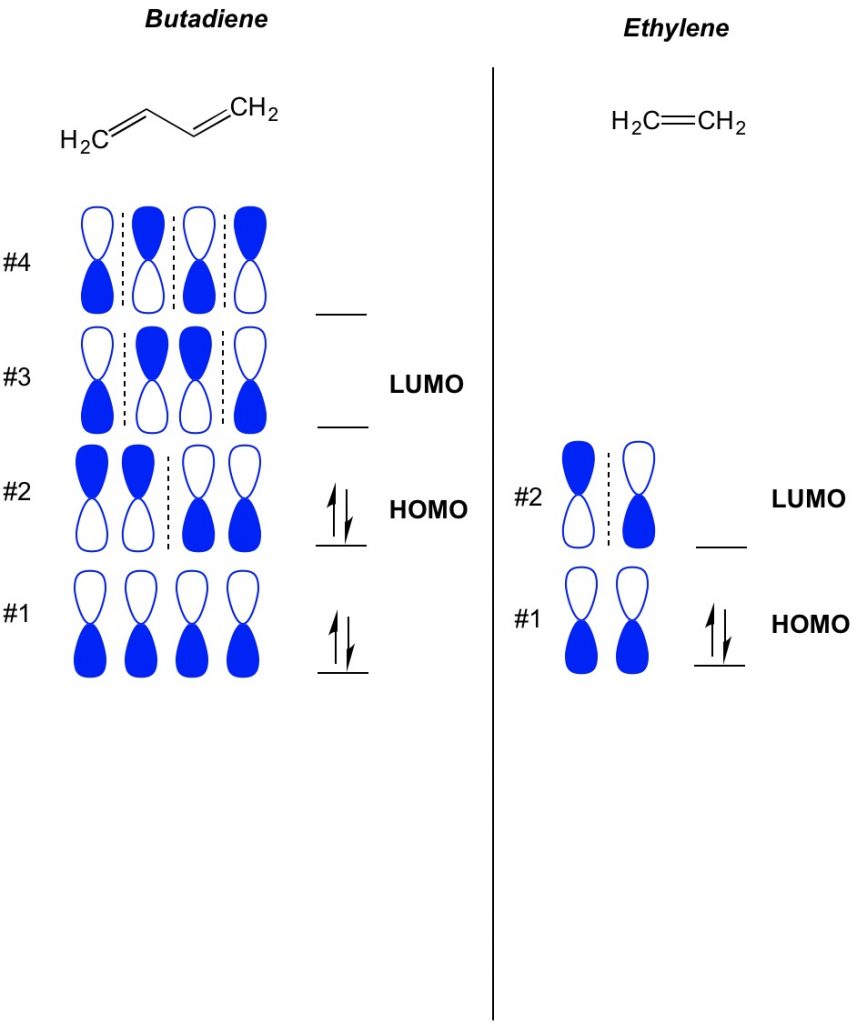
El concepto básico de la teoría MO es describir los patrones alternos de orbitales que existen en los sistemas de enlace pi. Describimos la orientación de cada mitad del orbital de mancuernas centrado alrededor de un átomo como audaz o abierta. Recuerde, hay orbitales adherentes y antibondantes. Esencialmente, los orbitales con un menor número de nodos (interruptores en la orientación del orbital de mancuernas que mostramos con la línea discontinua) se comportan más como orbitales de unión, mientras que los orbitales con un mayor número de nodos se comportan como orbitales anti-unión. Para determinar qué orbitales están ocupados en su molécula, simplemente cuente cuántos enlaces pi tiene en su sistema conjugado. A continuación se muestra un ejemplo de butadieno. Tiene 4 electrones pi, así que primero llenamos los orbitales moleculares más bajos, dos en cada orbital. Por lo tanto, el orbital molecular ocupado más alto, u HOMO, en butadieno es #2. Como resultado, el obital molecular no ocupado más bajo, o LUMO, en butadieno es el # 3. Podemos extender esto al etileno y ver que con 2 electrones pi, el orbital molecular #1 es el HOMO y el orbital molecular # 2 es el LUMO.
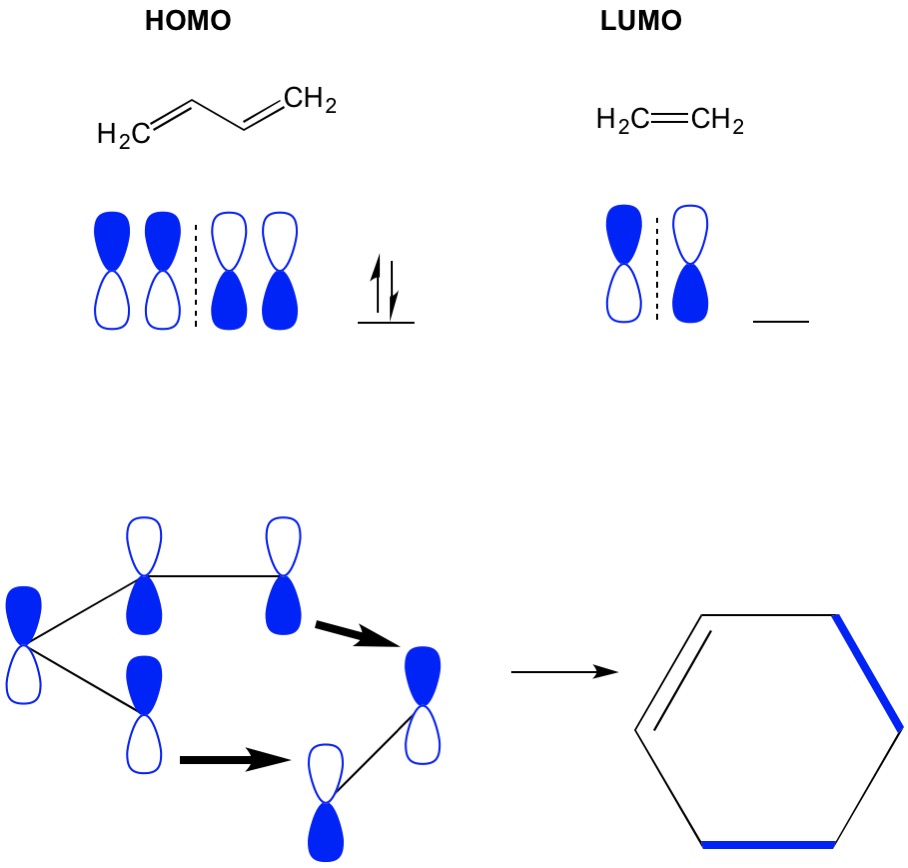
Teoría de cicloadiciones MO
Recuerde que las reacciones de cicloadición describen la formación de nuevos enlaces sigma C-C a través del reordenamiento de los electrones pi en un sistema conjugado. Por lo tanto, necesitamos usar los orbitales moleculares de los electrones pi para impulsar la reacción. Tomemos la reacción de butadieno con etileno, la reacción de aliso de Diels más simplista (cicloadición 4+2). Comenzamos con la molécula más conjugada, el butadieno, y examinamos su HOMO. Luego observamos la molécula menos conjugada, el etileno, y examinamos su LUMO. ¿Por qué? Necesitamos que los electrones de un HOMO fluyan de una molécula a otra, por lo que tenemos que usar el orbital LUMO que no está ocupado para este proceso. Vemos que los nodos del HOMO y del LUMO se alinean; es decir, las mitades abiertas y cerradas de las mancuernas se alinean. Esto conduce a una reacción hacia adelante y a la formación del producto, el ciclohexeno.
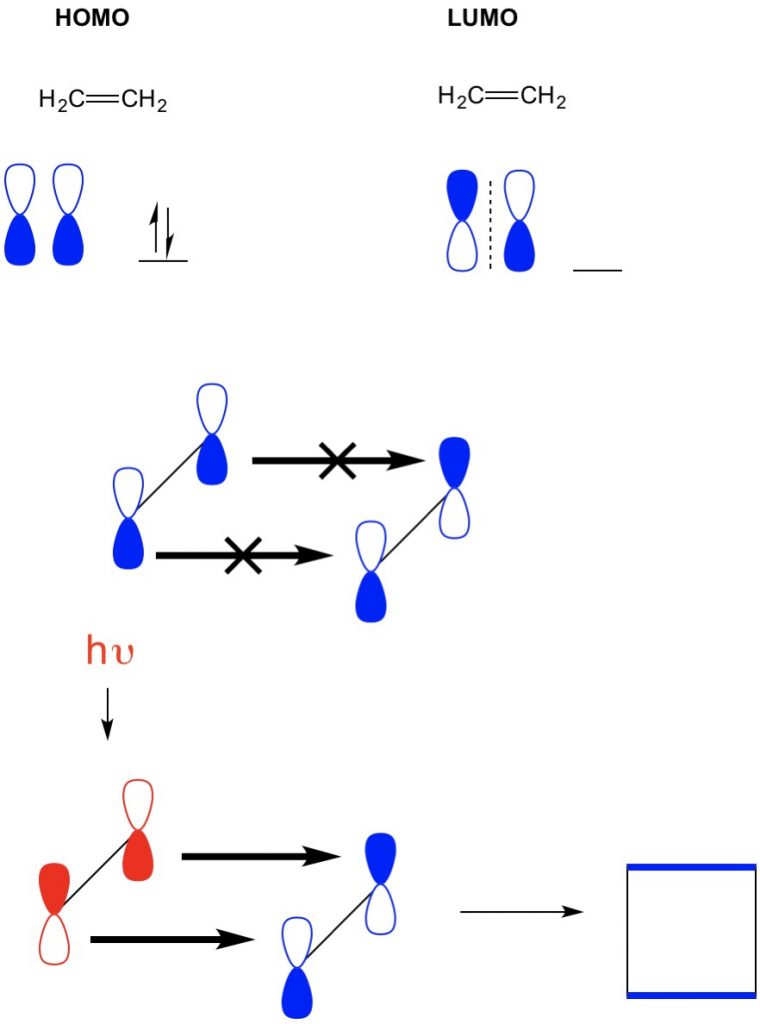
Sin embargo, en otro ejemplo donde tenemos una (cicloadición 2 + 2), vemos que el HOMO y el LUMO de etileno no se alinean, lo que prohíbe la reacción. Sin embargo, tenemos la capacidad de excitar electrones del HOMO a un orbital superior usando luz (hv) o calor, cambiando así el HOMO. Revisamos este concepto en detalle en un artículo anterior. Cuando hacemos esto, el HOMO del etileno excitado y el LUMO del etileno en estado fundamental se alinean y la reacción produce ciclobutano.
Esperamos que esta descripción haya ayudado a aclarar estos conceptos de la teoría de MO. Este es un ejemplo de las ampliaciones claras y simples que hemos preparado para más de 175 reacciones que se ven comúnmente en los cursos Orgo1 y Orgo2. Regístrese hoy para sus necesidades de preparación de estudio!