uczeń chemii
co to jest Współrzędnościowe wiązanie kowalencyjne?
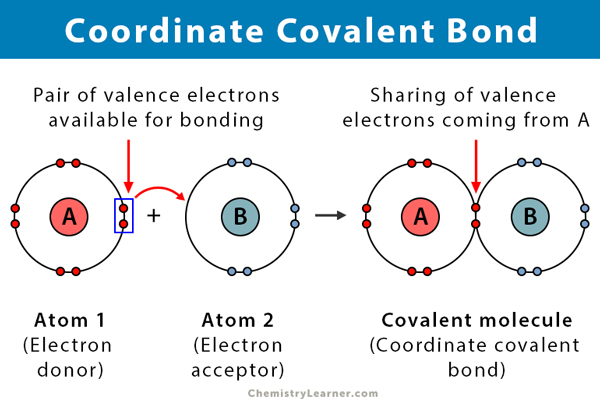
wiązanie kowalencyjne powstaje, gdy dwa atomy dzielą elektrony. Współrzędnościowe wiązanie kowalencyjne, znane również jako celowe wiązanie kowalencyjne, jest rodzajem wiązania kowalencyjnego, w którym wspólna para elektronów pochodzi z jednego z atomów. Atomy są utrzymywane razem, ponieważ oba jądra przyciągają parę elektronową. Po utworzeniu wiązania kowalencyjnego niemożliwe jest rozróżnienie pochodzenia elektronów. Ten rodzaj wiązania jest zwykle obserwowany w wiązaniu jonów metali z ligandami. Jednak niemetale mogą również uczestniczyć w tej więzi. Reakcja między kwasem Lewisa a zasadą jest współrzędnym wiązaniem kowalencyjnym .
jon kompleksowy składa się z dwóch rzeczy, jonu metalu i związków zwanych ligandami. Ligandy są obojętnymi cząsteczkami lub jonami zawierającymi pojedyncze pary elektronów, które mogą wiązać się z jonami metalu. Najczęstszymi ligandami są amoniak (NH3), woda (H2O) i jony halogenkowe (Cl–, Br–). Ligandy są uważane za zasady Lewisa, ponieważ dzielą swoje pary elektronów z jonami metalu. Jony metali są zawsze dodatnie, więc są dość atrakcyjne dla samotnych par elektronów.
fakty i właściwości Coordinate Covalent Bond
coordinate covalent bond ma wiele podobieństw do wiązania kowalencyjnego. Oto niektóre z jego właściwości:
- odbywa się między donorem elektronu a akceptorem elektronów, zazwyczaj między metalem a ligandem
- odbywa się między różnymi atomami
- utworzonymi przez współdzielenie elektronów przekazanych przez jeden z atomów
- sztywne i kierunkowe
- Polarne
- Atomy podążają za zasadą oktetu
- atom oddający elektrony nazywa się donorem, a ATOM przyjmujący je nazywa się akceptorem.
- związki są słabo rozpuszczalne w wodzie
przykłady wiązania kowalencyjnego o współrzędnych
oto kilka przykładów cząsteczek, w których istnieje wiązanie kowalencyjne o współrzędnych .
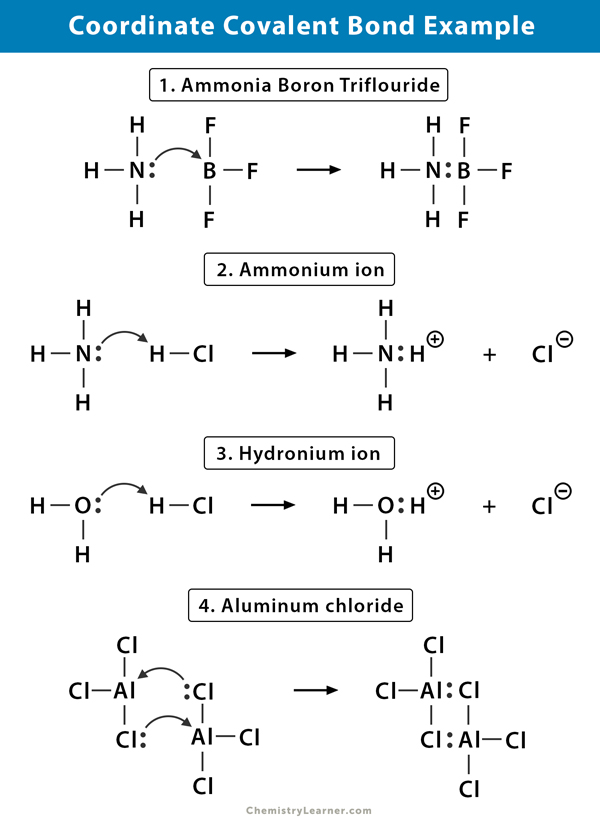
jon amonowy (NH4+)
jon amonowy powstaje w wyniku reakcji amoniaku (NH3) z gazem chlorowodorowym (HCl). W NH4+ czwarty wodór jest przyłączony przez współrzędną wiązanie kowalencyjne, ponieważ tylko jądro wodoru jest przenoszone z chloru do azotu. Elektron wodoru pozostaje na chlorze, tworząc ujemny jon chlorkowy (Cl -).
Trifluorek boru amoniaku (NH3.BF3)
trifluorek boru (BF3) jest związkiem, który nie ma struktury gazu szlachetnego wokół atomu boru (B). BOR ma tylko trzy pary elektronów w swojej falbance shell i wymaga pary, aby zakończyć orbital. Stąd BF3 jest niedoborem elektronów. Samotna para na azocie (N) cząsteczki amoniaku (NH3) jest używana do przezwyciężenia tego niedoboru, a złożony związek tworzy się poprzez koordynacyjne wiązanie kowalencyjne.
jon Hydroniowy (H3O+)
gdy gaz chlorowodorowy (HCl) rozpuszcza się w wodzie, tworząc kwas solny (HCl aq.), w Jonie hydroniowym powstaje wiązanie kowalencyjne. Jądro wodoru (H) jest przenoszone do cząsteczki wody (H2O), która ma samotną parę elektronów, tworząc hydronium. Więc H nie wnosi żadnych elektronów do wiązania.
chlorek glinu (Al2Cl6)
Wiązanie w chlorku glinu (AlCl3) jest zasadniczo kowalencyjne. Każdy atom glinu (Al) Ma deficyt dwóch elektronów w swojej walencyjnej powłoce, a chlor (Cl) ma samotną parę. Al tworzy współrzędną wiązanie kowalencyjne z atomem Cl na sąsiedniej grupie AlCl3. Jak robi to każdy z dwóch atomów Al, wtedy chlorek glinu jest kowalencyjną cząsteczką dimeru o wzorze Al2Cl6.
tlenek węgla (co)
węgiel (C) ma cztery elektrony w powłoce walencyjnej, a tlen (O) ma sześć. Zarówno węgiel, jak i tlen dzielą swoje dwa elektrony. Podczas gdy zasada oktetu jest zadowolona z tlenu, nadal występuje deficyt dwóch elektronów na węglu. Tak więc tlen dzieli swoje dwa elektrony z węglem, tworząc koordynacyjne wiązanie kowalencyjne, oprócz dwóch regularnych (podwójnych) wiązań kowalencyjnych.