Posts Tagged „teoria MO; cykloaddycja; Chemia organiczna; HOMO; LUMO; sprzężony system”
jednym z najtrudniejszych pojęć w sprzężonych reakcjach systemowych są molekularne interakcje orbitalne lub teoria MO. Podstawy tej zasady mogą być trudne do zrozumienia, ale będą bardzo pouczające w przewidywaniu prawidłowych warunków reakcji i wyniku reakcji, jeśli je zrozumiesz, co da ci znaczną przewagę na przyszłych quizach i egzaminach. My w StudyOrgo opracowaliśmy proste wyjaśnienie podstaw teorii MO, aby pomóc ci w przygotowaniach do nauki.
zasady teorii MO
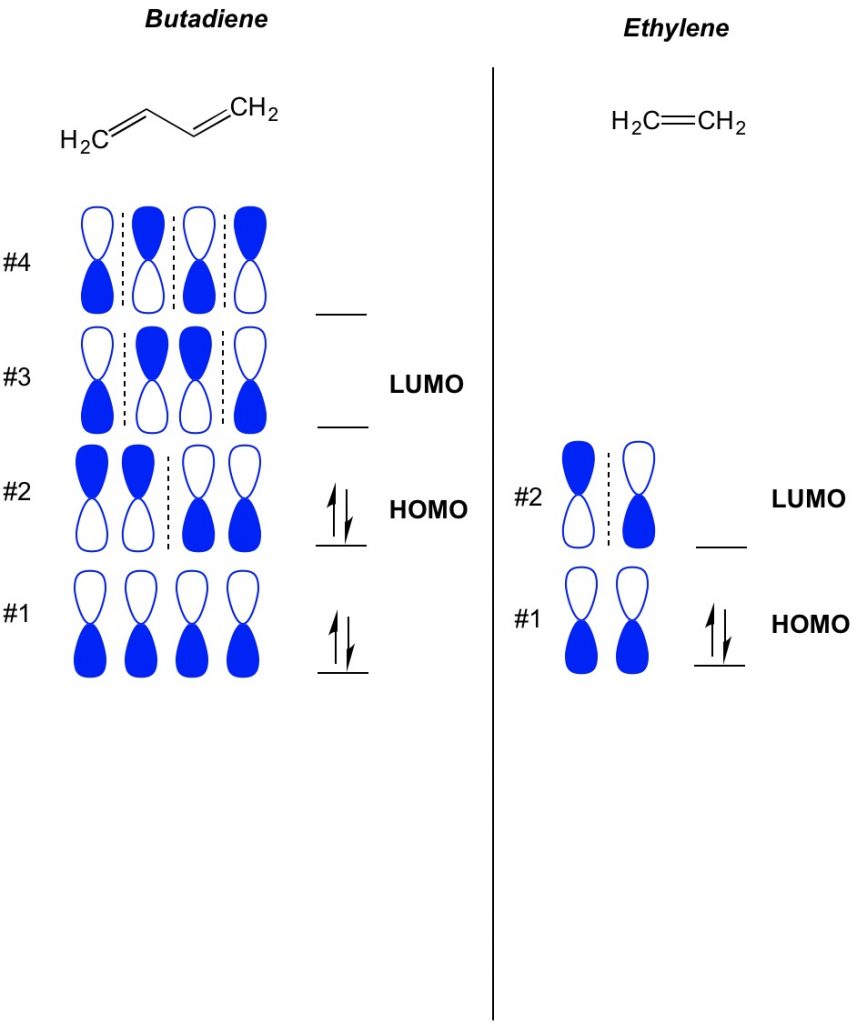
podstawowym pojęciem teorii MO jest opisanie przemiennych wzorów orbitali występujących w układach wiązań pi. Orientację każdej połowy orbity hantli skupionej wokół atomu opisujemy jako pogrubioną lub otwartą. Pamiętaj, że są wiązania i antybonding orbitali. Zasadniczo orbitale z mniejszą liczbą węzłów (przełączniki w orientacji orbitalu hantla, które pokazujemy z przerywaną linią) zachowują się bardziej jak orbitale wiążące, podczas gdy orbitale z większą liczbą węzłów zachowują się jak orbitale antywibracyjne. Aby określić, jakie orbitale są zajęte w cząsteczce, po prostu policz, ile wiązań pi masz w sprzężonym układzie. Poniżej przykład butadienu. Ma 4 elektrony pi, więc najpierw wypełniamy najniższe orbitale molekularne, po dwa w każdym orbitalu. W związku z tym najwyższym zajętym orbitalem molekularnym, czyli HOMO, w butadienu jest # 2. W rezultacie najniższy nieobsadzony molekularnie obital, czyli LUMO, w butadienu wynosi # 3. Możemy rozszerzyć to na etylen i zobaczyć, że z 2 elektronami pi, Orbital molekularny # 1 to HOMO, a Orbital molekularny # 2 to LUMO.
Cykloaddycja teoria mo
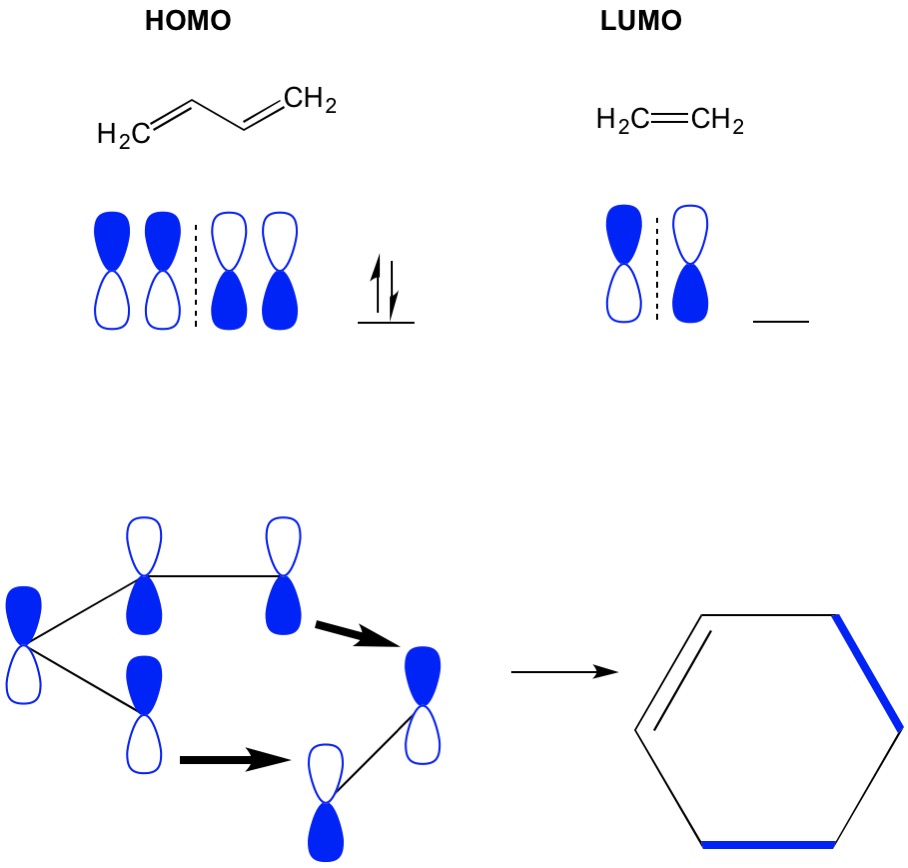
pamiętaj, że reakcje cykloaddycji opisują tworzenie nowych wiązań C-C sigma poprzez rearanżację elektronów pi w układzie sprzężonym. Dlatego musimy użyć orbitali cząsteczkowych elektronów pi do kierowania reakcją. Weźmy reakcję butadienu z etylenem, najbardziej uproszczoną reakcję Dielsa Aldera (4+2 cykloaddycja). Zaczynamy od najbardziej sprzężonej cząsteczki, butadienu i badamy jej HOMO. Następnie przyjrzymy się najmniej sprzężonej cząsteczce, etylenowi i zbadamy jej LUMO. Dlaczego? Potrzebujemy elektronów HOMO do przepływu z jednej cząsteczki do drugiej, więc musimy użyć orbitalu LUMO, który nie jest zajęty do tego procesu. Widzimy, że węzły HOMO i LUMO wyrównują się; to jest otwarta i zamknięta połówka hantli wyrównuje się. Prowadzi to do dalszej reakcji i powstania produktu, cykloheksenu.
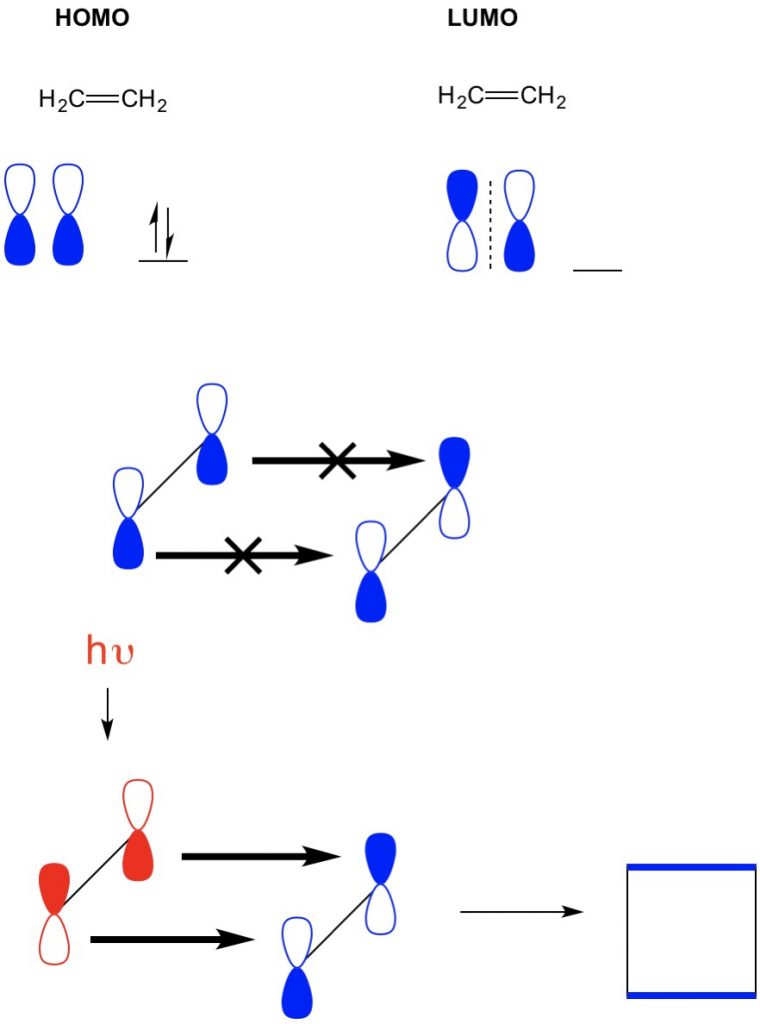
jednak w innym przykładzie, w którym mamy cykloaddycję 2+2, widzimy, że HOMO i LUMO etylenu nie wyrównują się, co uniemożliwia reakcję. Jednak mamy zdolność do wzbudzania elektronów z HOMO do wyższego orbitalu za pomocą światła (hv) lub ciepła, zmieniając w ten sposób HOMO. Szczegółowo omawiamy tę koncepcję w poprzednim artykule. Kiedy to zrobimy, HOMO wzbudzonego etylenu i LUMO etylenu w stanie podstawowym wyrównają się i reakcja wytwarza cyklobutan.
mamy nadzieję, że ten opis pomógł wyjaśnić te pojęcia teorii MO. Jest to przykład jasnych i prostych ekspatriacji, które przygotowaliśmy dla ponad 175 reakcji powszechnie obserwowanych na kursach Orgo1 i Orgo2. Zapisz się już dziś, aby przygotować się do nauki!