Enzymy graniczne szczoteczki jelitowej
Patofizjologia VIVO
enzymy graniczne szczoteczki jelitowej
ostatni etap trawienia węglowodanów i białek dietetycznych występuje na powierzchni enterocytów jelitowych, w bezpośrednim sąsiedztwie transporterów, które transportują powstałe cukry i aminokwasy do komórek nabłonkowych. Enzymy odpowiedzialne za ten końcowy etap trawienia nie są wolne w świetle jelita, ale raczej uwięzione jako integralne białka błonowe w błonie osocza enterocytów. Szczytowa błona plazmatyczna, w której znajdują się te enzymy, składa się z licznych mikrowilli, które rozciągają się od komórki i stanowią „bruzdę”. Stąd enzymy osadzone w tych mikrowilli są określane jako enzymy brush border.
gęstość i rozmieszczenie enzymów brusznicowych różni się między różnymi segmentami jelita cienkiego i często zmienia się w zależności od wieku zwierzęcia. Dodatkowo, w niektórych przypadkach stężenie takich enzymów może być modulowane przez dietę; na przykład zwiększa się ilość enzymu sukrazowo-izomaltazy u zwierząt karmionych dietą o wysokiej zawartości węglowodanów.
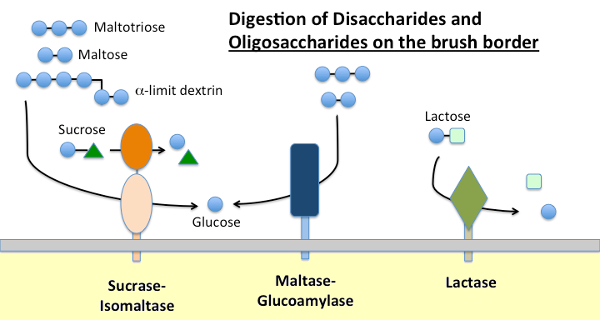
maltaza-Glukoamylaza i Sukraza-Izomaltaza
skrobia dietetyczna jest trawiona przez α-amylazę obecną w wydzielinie trzustki oraz, u wielu gatunków, ślinę. Amylaza hydrolizuje wewnętrzne wiązania α-1,4 glikozydowe w skrobi w celu wytworzenia maltozy, krótkich oligosacharydów (np. maltotriozy) i tak zwanych dekstryn granicznych, które są punktami rozgałęzienia w amylopektynie. Żadna z tych cząsteczek nie może zostać wchłonięta przez nabłonek jelita cienkiego i wymaga dalszej hydrolizy, ostatecznie do glukozy.
maltaza-glukoamylaza i sukraza-izomaltaza są blisko spokrewnionymi enzymami osadzonymi w błonie brush border, które wykonują końcowe etapy trawienia za pomocą substratów dostarczanych przez działanie amylazy:
- maltaza-glikoamylaza ma dwa aktywne miejsca. Miejsce maltazy hydrolizuje końcowe reszty D-glukozy związane z α-1,4 z maltozy lub maltotriozy, wytwarzając α-D-glukozę. Miejsce glukoamylazy ma również aktywność hydrolazy α – 1,4, ale także hydrolizuje wiązania α-1,6 glikozydowe, gdy sąsiadują z wiązaniem α-1,4, uwalniając β-D-glukozę.
- Sukraza-izomaltaza ma również dwa aktywne miejsca o różnej specyficzności. Miejsce sukrazy katalizuje hydrolizę sukrazy do fruktozy i glukozy, a także jest zdolne do hydrolizy maltozy. Miejsce izomaltazy jest ważne jako główny mechanizm trawienia wiązań α-1,6 granicznych dekstryn.
Laktaza
Laktaza, jak sama nazwa wskazuje, jest disacharydazą, która hydrolizuje laktozę do galaktozy i glukozy; formalnie jest β-glikozydazą. Laktoza jest głównym węglowodanem w mleku, a laktaza jest obficie obecna w bruzdach jelitowych małych ssaków. U większości gatunków, w tym u ludzi, ekspresja laktazy spada wkrótce po odstawieniu od piersi. U większości ludzi brak utrzymywania się aktywności laktazy w wieku dorosłym wiąże się z”nietolerancją laktozy”. Różnica między trwałością laktazy a trwałością jest uwarunkowana genetycznie.
peptydazy
istnieje duża liczba peptydaz brush border, które łącznie mogą hydrolizować różnorodność sekwencji aminokwasowych obecnych w białkach dietetycznych. Główne klasy peptydaz obejmują:
- Egzopeptydazy, które hydrolizują końcowe aminokwasy z peptydów. Niektóre z tych enzymów mają aktywność przeciwko reszt C-końcowych, a inne działają na N-końcowych aminokwasów. Ich aktywność daje wolne aminokwasy lub dipeptydy. Jako przykład enzymatycznej specyficzności i różnorodności, aminopeptydaza P hydrolizuje N-końcowy aminokwas z di -, tri-i oligopeptydów, ale tylko wtedy, gdy są one połączone z proliną, podczas gdy aminopeptydaza a katalizuje hydrolizę końcowych kwaśnych aminokwasów, takich jak glutaminian i asparaginian.
- Endopeptydazy rozszczepiają łańcuchy peptydowe wewnętrznie, dając mniejsze peptydy o różnej długości łańcucha.
- pojedyncza dipeptydaza istnieje również jako enzym graniczny.
Enteropeptydaza, znana również jako enterokinaza, jest kolejnym enzymem granicznym, który ma ważną aktywność katalizującą aktywację trypsynogenu do trypsyny, jednej z głównych proteaz trzustki. Enteropeptydaza występuje najobficiej w dwunastnicy.
lipazy
w bruzdach jelita cienkiego występuje wiele lipaz. Należą do nich fosfolipaza B1, neutralna ceramidaza i zasadowa sfingomyelinaza.