Zwak in de knieën: Miller Fisher-syndroom
Miller Fisher-syndroom (MFS), een zeldzame, zelfbeperkende variant van het Guillain-Barré-syndroom (GBS), is een anti-gq1bigg-antilichaamsyndroom dat het perifere en centrale zenuwstelsel aantast.1 een acute neuromusculaire polyneuropathische aandoening, MFS veroorzaakt een oplopende verlamming met een klassieke presentatie triade van oftalmoplegie, ataxie en areflexie. Onderzoekers beschreven de klinische triade voor het eerst in 1932.1 twee decennia later, was de Canadese slagspecialist Charles Miller Fisher de eerste om een rapport in 1956 te publiceren dat de klinische bevindingen beschreef en de voorwaarde als een beperkte vorm van GBS definieerde.2
symptomen treden op gedurende meerdere dagen, vaak in de winter en het voorjaar, meestal na een virale infectie, en patiënten ervaren vaak diplopie als een van de eerste symptomen. Wanneer een patiënt zich presenteert met symptomen zoals intermitterende esotropie, verstoorde horizontale bezigheden en vaste mydriatische pupillen, en uw neurologisch onderzoek is abnormaal, is het tijd om te denken aan abs, in het bijzonder MFS. Het volgende geval illustreert de relevante tekenen en symptomen en weerspiegelt de typische uitkomst.
voorgeschiedenis
een 27-jarige blanke man die tijdens de voorjaarsmaanden naar de VA-Oogkliniek werd gebracht en melding maakte van acute binoculaire diplopie die één dag daarvoor begon. De patiënt zei dat het constant was, maar alleen bij het bekijken op afstand met objecten horizontaal verplaatst. Er was geen oogpijn of wazig zien geassocieerd met de diplopie. Hij klaagde ook over recente duizeligheid en evenwichtsproblemen. Hij rapporteerde een sinusinfectie met significante paranasale congestie die een week voor het dubbelzien begon. Eerdere oculaire en medische geschiedenissen waren onopvallend; de patiënt nam momenteel geen medicijnen en had geen medicatie allergieën.
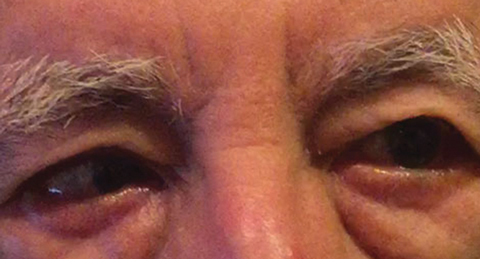
Fig. 1. De differentiële diagnose na baseline onderzoek omvatte een gedeeltelijke rechter CN VI parese, wat kan wijzen op een vasculaire aandoening, zoals hier te zien is bij een andere patiënt. Klik op de afbeelding om te vergroten. Foto: Michael DelGiodice, od
diagnostische gegevens
bij baseline-onderzoek was de ongecorrigeerde visuele acuities 20/20-2 OD en 20/25-2 OS. Pupillen waren 5mm even rond en reageerden op licht zonder afferente pupillaire afwijking. Extraoculaire motieven waren vol, glad en nauwkeurig in beide ogen zonder beperkingen. De dekking test op afstand toonde een intermitterende vier tot zes prisma diopter rechts esotropie in primaire blik die ongeveer 50% van de tijd. Het uitvoeren van de cover test bij de buurt bleek een vier prisma diopter slokdarm in primaire blik zonder tropia.
hoewel dit in dit geval niet wordt uitgevoerd, moeten artsen de test in primaire, rechter en linker blik behandelen. Bij patiënten met diplopie zal craniale zenuw zes (CN VI) parese zich manifesteren als niet – comitante afwijking, erger in de rechter of linker blik, afhankelijk van aan welke kant de parese zich bevindt. Een decompenserende phorie zal daarentegen een komitante afwijking vertonen.
refractieve fout was -0,50 D bol OD en -0,75 D bol OS en het zicht was in elk oog corrigeerbaar tot 20/20. De intraoculaire druk was in beide ogen binnen de normale grenzen. De bevindingen van het voorste en achterste segment waren onopvallend in de rechter-en linkerogen. De oogzenuwen leken gezond met een cup-to-disc Verhouding van 0,15 in beide ogen.
Differentižle diagnoses omvatten een partiële rechtse CN VI parese (figuur 1), myasthenia gravis, een drukproces en een decompenserende afstands-oesoforie die een intermitterende rechtse esotropie veroorzaakte. De patiënt ontkende elke voorgeschiedenis van binoculaire diplopie.
beeldvorming van de hersenen en orbits werd bevolen door de oogkliniek om hersenbetrokkenheid, inclusief een druklaesie, uit te sluiten. Computertomografie (CT) scans van de hersenen en banen werden uitgevoerd en geïnterpreteerd door de staf neuroradioloog. CT werd gekozen in plaats van magnetic resonance imaging (MRI) vanwege timing en beschikbaarheid; testen en resultaten konden worden verkregen op dezelfde dag met CT in de kliniek na uren. De resultaten waren onopvallend zonder tekenen van intracraniale bloeding, drukletsel of acuut infarct.
CT van de paranasale sinussen toonde matige tot ernstige chronische paranasale sinusziekte en volledige opacificatie van de rechter maxillaire sinus. Er was geen verlenging in de baan. De huisarts van de patiënt werd geïnformeerd over de symptomen van de patiënt, de bevindingen van het oogonderzoek en de resultaten van CT-beeldvorming en begon de behandeling voor maxillaire sinusitis met een orale azithromycine vijfdaagse dosisverpakking en instrueerde de patiënt om follow-up te geven met de oogkliniek.
de patiënt keerde vijf dagen later terug na het voltooien van zijn orale Azithromycin kuur en verklaarde dat hij geen verbetering in de afstand diplopie ervoer; bovendien ervoer hij het begin van significante fotofobie en perioculaire pijn rond beide ogen. De patiënt verklaarde dat zijn gangonevenwichtigheid en loopmoeilijkheden ook verergerden. Bij onderzoek bleven de best gecorrigeerde gezichtsscherpte 20/20 in de rechter-en linkerogen. Pupillen werden verwijd bij 8,5 mm Zonder reactiviteit op licht in beide ogen (Figuur 2). Extraoculaire beweeglijkheid toonde laterale beperking met pijn bij beweging in het rechteroog en mediale beperking met pijn bij beweging in het linkeroog in overeenstemming met een rechteroogverlamming (Figuur 3). Horizontale en verticale bezigheden waren saccadic met onnauwkeurige en schokkerige bewegingen. Anterieure en posterieure segment bevindingen bleven onopvallend OU.
differentiële diagnoses na oftalmologisch onderzoek omvatten Left internuclear oftalmoplegie, rechterkijker parese en rechterkijker parese met left internuclear oftalmoplegie, wat de bevindingen van extraoculaire motiliteit zou kunnen verklaren. Andere verschillen zijn een middenhersenlaesie of myasthenia gravis. Differentiële diagnoses voor pupil dilatatie omvatten derde zenuw (CN III) verlamming, trauma en farmacologische dilatatie. De patiënt had geen andere bevindingen die overeenkomen met een derde zenuwverlamming en ontkende trauma of blootstelling aan farmacologische middelen.
de patiënt werd doorverwezen naar neurologie voor verdere beoordeling. Neurologisch onderzoek meldde dat de patiënt volledig alert en georiënteerd was zonder verlies van gezichtsgevoel. De patiënt vertoonde milde ataxie met moeilijkheid die in tandem lopen en zich van een het kraken positie bevinden. Proximale zwakte in zowel de bovenste als onderste ledematen en abnormale reflexen waren aanwezig. Alle zintuigen waren intact. MRI en magnetische resonantie angiografie (MRA) van de hersenen en banen waren onopvallend. Het eiwit van het cerebrospinale vocht was verhoogd bij 75 mg/dL (referentiebereik: 15 mg/dL tot 45 mg / dL) zonder andere afwijkingen. Elektromyogram testen was onopvallend en toonde geen afwijkingen in zenuwgeleiding van de wervelkolom naar de voeten en handen.
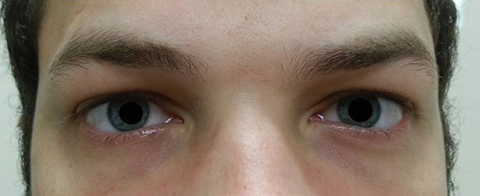
Fig. 2. De pupillen van de patiënt waren verwijd met 8,5 mm Zonder reactiviteit in de rechter-of linkerogen. Klik op de afbeelding om te vergroten.
diagnose
de patiënt vertoonde acute symptomen van diplopie, ataxie en areflexie. Gezien de intermitterende rechter esotropie, verminderde horizontale bezigheden, vaste mydriatische pupil, milde ataxie en abnormale reflexen op neurologisch onderzoek en verhoogde cerebrospinale vloeistof eiwit, werd de diagnose MFS gemaakt. De patiënt werd opgenomen in het ziekenhuis om te controleren op verdere complicaties. De patiënt kreeg een ooglapje ter dekking van het rechteroog indien nodig voor diplopie.
Er bestaan momenteel geen gepubliceerde diagnostische criteria voor het syndroom van Miller Fisher. De diagnose wordt meestal gemaakt door de presentatie van de klinische triade samen met beeldvorming en cerebrospinale vloeistof studies. MRI is typisch onopvallend in de voorwaarde, hoewel sommige studies centrale laesies in de middenhersenen, pons en lagere medulla hebben getoond. Elektrofysiologische studies tonen verminderde of abnormale perifere sensorische geleiding.
eiwit in het cerebrospinaal vocht is vaak verhoogd zonder andere abnormale bevindingen. In een baanbrekende studie toonde 64,4% van de MFS-patiënten een verhoogd ruggenmergvochteiwit.8 een positieve anti – Gq1b IgG antilichaamtest staat voor een definitieve diagnose toe. In één studie was anti-Gq1b IgG-antilichaam aanwezig bij maximaal 95% van de patiënten met de aandoening en afwezig in de controlegroep.3
de neuroloog diagnosticeerde de patiënt met MFS op basis van de klinische triade van oftalmoplegie, ataxie en areflexie, een onopvallende MRI en MRA van de hersenen en een verhoogd eiwit in de cerebrospinale vloeistof. Daarom werd in dit geval geen anti-Gq1b IgG-antilichaamtest uitgevoerd.
verschillende klinische kenmerken van MFS worden ook gezien bij het syndroom van Guillain-Barré en Bickerstaff ‘ s hersenstam encefalitis, waardoor de diagnose uitdagend is. Patiënten met alleen Guillain-Barré vertonen zwakte van de ledematen, zintuiglijk verlies, craniale neuropathie en areflexie zonder oogheelkundige manifestaties. Patiënten met Bickerstaff ‘ s hersenstam encefalitis meestal aanwezig met oftalmoplegie, ataxie, hyper-reflexie en een gestoord bewustzijn. Aangezien verscheidene symptomen en tekens in alle drie voorwaarden aanwezig zijn, is het testen van de anti-Gq1b IgG antilichaamtiter nuttig voor een meer definitieve diagnose. Anti-Gq1b IgG-antilichaam is positief bij een grote meerderheid van de patiënten met het syndroom van Miller Fisher, vergeleken met 66% bij de hersenstam-encefalitis van Bickerstaff en 26% bij patiënten met het syndroom van Guillain-Barré.16
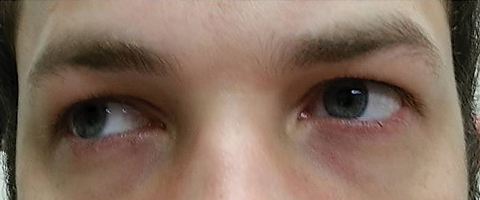
Fig. 3. Extraoculaire motieven onthulden beperking in dextroversie. Klik op de afbeelding om te vergroten.
behandeling en Follow-up
de patiënt werd de dag na opname geëvalueerd, toen hij verklaarde dat hij geen visuele veranderingen of verbetering in evenwicht ervoer. Binoculaire diplopie was nog steeds constant; daarom bleef het rechteroog gepatcht. Oogpijn met verre blikken en snelle oogbewegingen waren nog steeds aanwezig. Bij beperkt bedonderzoek bleven de best gecorrigeerde gezichtsscherpte 20/20 in de rechter-en linkerogen. Pupillen waren verwijd om acht uur.0mm in beide ogen met minimale reactiviteit, die iets verbeterd was ten opzichte van de dag ervoor. Kleurenzicht was normaal in de rechter-en linkerogen. Extraoculaire motieven waren vol in alle kwadranten met pijn nog steeds aanwezig op ver horizontale blikken. Horizontale bezigheden bleven saccadic met schokkerige bewegingen en eindpunt nystagmus. De oogzenuwen leken gezond met duidelijke marges en een cup-disc Verhouding van 0,15 in beide ogen.
twee dagen later verklaarde de patiënt een verbetering van alle symptomen en dat zijn ogen “zich vandaag beter voelen dan in een tijdje.”Oogpijn en binoculaire diplopie verdwenen beide. De visuele scherpte bleef 20/20 in de rechter-en linkerogen. Pupil maten waren 7,5 mm in het donker en 7,0 mm in het licht met verbeterde directe en consensuele reacties in beide ogen. Extraoculaire beweeglijkheid was in alle kwadranten vol zonder oogpijn. Horizontale bezigheden bleven saccadic met schokkerige bewegingen en eindpunt nystagmus. Neurologisch onderzoek onthulde abnormale reflexen, die stabiel bleven. De behandelingsopties voor MFS omvatten plasmaferese en intraveneuze (IV) immunoglobuline IgG, maar deze werden onderbroken gezien de verbetering van oftalmoplegie en ataxie.
vier dagen later meldde de patiënt dat alle symptomen nog verbeterden, met enige moeite met concentreren en volgen tijdens het gebruik van de computer. De balans was voor 80% verdwenen en er waren weinig gevallen van diplopie op afstand. Acuities bleef 20/20 OU. De pupillen waren 5,5 mm in het donker en 4,0 mm in het licht met 3 + directe en consensuele reacties OU. Extraoculaire beweeglijkheid was in alle kwadranten vol zonder oogpijn. Horizontale bezigheden werden verbeterd, zonder saccadic bewegingen. Monoculaire accommodatie was normaal, die werd gemeten met respectievelijk 8,5 en 9 prism dioptrieën OD en OS.
een week later meldde de patiënt dat zijn gezichtsvermogen weer bijna normaal was, zonder diplopie en lichte problemen met concentreren en volgen. Het saldo was 100% opgelost. De visuele scherpte bleef 20/20 in de rechter-en linkerogen. Pupil maten waren 5,5 mm in het donker, 4,0 mm in het licht met 4 + directe en consensuele reacties OU. Extraoculaire beweeglijkheid was in alle kwadranten vol zonder oogpijn. Horizontale bezigheden verbeterd zonder waargenomen saccadische bewegingen. Oculaire gezondheid was onopvallend OU. de behandeling met
werd onderbroken vanwege het verdwijnen van oftalmoplegie en ataxie met stabiele areflexie. Volledig herstel van opthalmoplegie en ataxie duurde twee weken. De behandeling omvatte nauwkeurige controle en follow-up binnen vier weken; de patiënt werd geadviseerd eerder terug te keren als een van zijn symptomen terugkwam.
klinische kenmerken
In goed beschreven studies met MFS presenteerden alle patiënten de klinische triade van oftalmoplegie, ataxie en areflexie.De symptomen treden doorgaans op gedurende enkele dagen en patiënten lijden een virale infectie één tot vier weken voorafgaand aan het optreden van de klinische symptomen.4,5 volgens een studie van 50 patiënten met de aandoening is het gemiddelde interval tussen het begin van de infectie en de ontwikkeling van neurologische symptomen acht dagen.4 andere tekenen van MFS zijn onduidelijke spraak, moeite met slikken en een abnormale gezichtsuitdrukking met een onvermogen om te glimlachen of te fluiten.
oftalmologische kenmerken. Artsen moeten op de uitkijk staan voor mydriasis, het intrekken van het deksel, acute hoeksluiting en diplopie secundair aan zenuwverlammingen die CN III, IV en VI beïnvloeden.3,8,10,22,24 diplopie is het meest voorkomende oftalmologische symptoom dat in veel MFS-onderzoeken is gemeld.8,16,25,26,27 diplopie is ook het eerste symptoom dat werd gemeld bij 38,6% van de 223 patiënten in één landmark-studie en bij 65% van de 466 patiënten in een tweede studie.8,27 in het tweede onderzoek vertoonde 100% van de patiënten uitwendige oftalmoplegie, terwijl bij 35% van de patiënten interne oftalmoplegie aanwezig was.27 externe oftalmoplegie verwijst naar beschadiging van externe extraoculaire spieren. Interne oftalmoplegie verwijst naar stoornis van de pupillaire sluitspier en ciliaire spier. Volledige oftalmoplegie beïnvloedt zowel de externe als de interne spieren.
in een retrospectieve studie bij 19 patiënten met MFS, allen met een of meer zenuwverlammingen die de extraoculaire spieren aantasten.Andere studies tonen aan dat MFS-patiënten meerdere hersenzenuwverlammingen kunnen ervaren, die zich bilateraal kunnen manifesteren.Een veel voorkomende bevinding bij Anti-Gq1b IgG-positieve aandoeningen is een abductiedeficit dat consistent is met een unilaterale of bilaterale CN VI-parese.26,28 interne oftalmoplegie veroorzaakt pupil mydriasis, waarbij pupil vernauwing tot licht en / of in de buurt stimulatie kan variëren van minimaal tot afwezig.In één rapport was mydriasis aanwezig bij 42% van de patiënten. Betrokkenheid van CN VII trad op bij ongeveer 45,7% van de MFS-patiënten, wat zwakte in het gezicht, onvermogen om te glimlachen of te fluiten veroorzaakte.8
ataxie. De oorzaak van deze klinische eigenschap in MFS is niet volledig begrepen. Het debat bestaat over of ataxie door dysfunctie centraal in het cerebellum of periferally wordt veroorzaakt. De eerste hypothese, voorgesteld door Dr.Fisher, postuleerde de betrokkenheid van Ia-afferente neuronen.2 Dit werd ondersteund door een tweede studie decennia later, die afwijkingen van Ia-afferente vezels in MFS toonde.Abnormale aantasting van de perifere zenuwen is ook voorgesteld met een mismatch tussen proprioceptieve input van spierspindels en kinesthetische informatie van gewrichtsreceptoren.
Er is ook ondersteunend bewijs dat ataxie ontstaat in het cerebellum. Een overwicht van anti-GQ1b IgG antilichaam in het cerebellum werd gevonden met behulp van immunocytochemische kleuring van het humane cerebellum en verder bevestigd met western blot studies, die verhoogde anti-GQ1b IgG antilichaam bij MFS patiënten in vergelijking met controle, hoewel het mechanisme voor cerebellaire betrokkenheid niet is onderzocht.13,14 in 2015 publiceerden onderzoekers een case report van een MFS-patiënt die MRI onderging. Er was een verminderde n-acetylaspartaat/creatine ratio, wat wijst op cerebellaire disfunctie, die na herstel 2,5 maanden weer normaal werd.23
areflexie. Dit klinische kenmerk, samen met depressie van diepe peesreflexen, is een teken van betrokkenheid van het perifere zenuwstelsel bij MFS. Elektrofysiologische studies hebben abnormale perifere zenuwgeleiding in GBS en MFS gevalideerd.3 in één studie presenteerde 81,6% van de MFS-gevallen arefexie.8 Een andere mijlpaal studie toonde alle patiënten ervaren areflexie, die nog aanwezig zes maanden na aanvang was.4
hoe vaak komt MFS voor?
epidemiologische gegevens over het syndroom van Miller Fisher zijn beperkt. De incidentie van MFS is vrij zeldzaam, komt voor bij 0,09 per 100.000 mensen per jaar.3 MFS komt vaker voor bij patiënten met het syndroom van Guillain-Barré, van 3% tot 25%.4,6,7 deze associatie komt meer voor bij patiënten van Verre Oosten afkomst, die een mogelijke genetische component aan MFS suggereren. De gemiddelde leeftijd van begin is 43, met een bereik van 13 tot 78,5 MFS beà nvloedt mannetjes tweemaal zoveel als vrouwtjes met een verhouding van twee tot 1,03,5 MFS komt meer voor in de winter en de lente.5,6,8 de exacte oorzaak van de seizoensgebonden voorkeur is niet bepaald, maar is waarschijnlijk geassocieerd met de post-infectieuze aard van de voorwaarde aangezien bacteriële en virale besmettingen een auto-immune reactie hebben gevonden die productie van het anti-Gq1b IgG antilichaam in MFS veroorzaken.
Pathofysiologie
de pathofysiologie van het syndroom van Miller Fisher is niet goed begrepen; er bestaan echter verschillende hypothesen uit immunologische en histologische studies. Het is bekend dat de voorwaarde binnen het spectrum van anti-Gq1b IgG antilichaamsyndromen samen met Guillain-Barré syndroom en Bickerstaff ‘ s hersenstam encefalitis ligt.
ganglioside GQ1b is een groep complexe lipiden betrokken in het centrale en perifere zenuwstelsel. GQ1b is een component van de plasmamembraan structuur in craniale zenuwen die de extraoculaire spieren voeden en is betrokken bij de celfunctie bij de presynaptische neuromusculaire junctie.
een auto-immune mechanisme van een voorgaande triggerende infectie zal het anti-Gq1b IgG antilichaam produceren, dat de ganglioside gq1b functie beschadigt en demyelinisatie veroorzaakt. Histologische studies hebben demyelinisatie en axonale zwelling in perifere en oculomotorische craniale zenuwen aangetoond.Het anti-GQ1bIgG antilichaam is afwezig bij gezonde patiënten, maar positief bij meer dan 90% van de patiënten met MFS.16,25
bacteriële en virale infecties bleken een auto-immuunrespons te veroorzaken, wat de productie van het anti-GQ 1b IgG-antilichaam veroorzaakte. De volgende infectieuze agentia die in verband zijn gebracht met MFS zijn mycoplasma pneumonie, HIV, Campylobacter jejuni, Hemophilus influenza, Helicobacter pylori en Epstein-Barr virus.4,16 in een rapport dat 466 MFS-patiënten onderzocht, had 90% een antecedente ziekte, waaronder infectie van de bovenste luchtwegen, diarree of beide.
prognose en behandeling
Miller Fisher syndroom is een zelfbeperkende ziekte en heeft een over het algemeen positieve prognose. De symptomen verbeteren over het algemeen na een paar weken met volledig herstel typisch voorkomend in twee tot drie maanden. In één studie begon het herstel met een mediaan van 13 dagen vanaf het begin van de symptomen en na zes maanden was de oftalmoplegie en ataxie volledig verdwenen.In minder dan 3% van de gevallen is een recidief van 4,5 waargenomen.4,5
hoewel MFS doorgaans zelfbeperkend is, zijn systemische complicaties geassocieerd met de aandoening. Bovenste luchtweginfecties zijn gevonden bij 56% tot 76% van de MFS-patiënten, die kunnen evolueren tot ademhalingsfalen waarvoor mechanische beademing nodig is.4,18,19 andere zeldzame ernstige complicaties zijn cardiomyopathie, lactaatacidose en coma.3,20
de behandelingsopties voor MFS omvatten plasmaferese, IV immunoglobuline IgG en monitoring zonder behandeling. De onderzoekers stellen dat plasmaferese en IV IgG effectief kunnen zijn om de oplossingstijd te versnellen aangezien antilichaam Gq1b IgG in klasse is en de halfwaardetijd van IgG ongeveer 21 dagen is, wat langer is dan de vijf tot zes dagen halfwaardetijden van IgM en IgA.Er zijn echter geen gerandomiseerde, dubbelblinde, placebogecontroleerde studies uitgevoerd waarin deze behandelingen werden onderzocht.
in één retrospectief onderzoek werd niet aangetoond dat plasmaferese de kans op volledig herstel en de tijd tot het verdwijnen van ataxie en oftalmoplegie veranderde; verder had het interval van het begin tot het begin van de plasmaferesebehandeling geen invloed op de tijd tot het verdwijnen of op de ernst van de symptomen bij het begin. Echter, één geval rapport geeft aan dat plasmaferese is geïndiceerd wanneer ernstige ataxie, motorische en respiratoire stoornis aanwezig is.
patiënten dienen nauwlettend gevolgd te worden op het risico van het ontwikkelen van ernstige systemische complicaties zoals falen van de bovenste luchtwegen. Studies tonen geen significante verbetering aan in de hersteltijd met IV IgG-of plasmaferesebehandeling in MFS, dus monitoring kan de beste optie zijn voor een beoefenaar.
hoewel zeldzaam, hoeft de aandoening niet ongediagnosticeerd te worden. Door de belangrijkste klinische kenmerken te herkennen, kunnen artsen de oorzaak van de symptomen van hun patiënt onthullen en vertrouwen krijgen in een volledig herstel. Wang en Cantrell zijn staf optometristen bij het Orlando VA Medical Center. Cali is een staf optometrist bij de Lee County VA Clinic. De auteurs willen Joseph Miller, OD, Paul Gruosso, OD, en Vanessa Santos, OD, bedanken voor de hulp met dit manuscript.
1. Collier J. perifere neuritis: de Morisa lezingen. Edinburgh Med J. 1932: 39: 601-18.
2. Fisher M. een ongebruikelijke variant van acute idiopathische polyneuritis (syndroom oftalmoplegie, ataxie, en areflexie). N Eng J Med. 1956:255:57-65.
3. Lo YL, et al. Klinisch en immunologisch spectrum van het Miller Fisher syndroom. Spierzenuw. 2007:36(5):615-27.
4. Mori M, Kuwabara S, Fukutake T, et al. Klinische kenmerken en prognose van het Miller Fisher syndroom. Neurologie. 2001:56(8): 1105-6.
5. Mori M, Kuwabara S, Fukutake T, et al. Plasmapharese en Miller Fisher syndroom: analyse van 50 opeenvolgende gevallen. J Neurol Neurochirurg Psych. 2002:72:680.
6. Yuan CL, Wang YJ, Tsai CP. Miller Fisher syndrome: a hospital based retrospective study. Euro J Neurol. 2000:44(2):79-85.
7. Cheng BC, Chang WN, Chang CS et al. Guillain-Barré syndroom in het zuiden van Taiwan: klinische kenmerken, prognostische factoren en therapeutische resultaten. Euro J Neurol. 2003:10 (6):655-62.
8. Berlit P, Rakicky J. Het Miller Fisher syndroom. Literatuuronderzoek. J klinische neuro-oftalmologie. 1992:12:57-63.
9. Lyu RK, Tang LM, Cheng SY, et al. Guillain-Barré syndroom in Taiwan: een klinisch onderzoek bij 167 patiënten. J Neurol Neurochirurg Psych. 1997:63:494-500.
10. Tatsomoto M, Odaka M, Hirata K, Yuki N. geïsoleerde abducens verlamming als een regionale variant van Guillain-Barré syndroom. J Neurol Sci. 2006:243:35-8.
11. Weiss JA, White JC. Correlatie van 1A afferente geleiding met ataxie van Fisher syndroom. Spierzenuw. 1986:9:327-32.
12. Das P, Biswash s, et al. Miller Fisher variant van guillain-barré syndroom: een case report en klinische review. Bangabandhu Sheikh Mujib Medical Univer J. 2012:5(1):69-71
13. Kornberg AJ, Pestronk A, Blume GM, et al. Selectieve kleuring van de cerebellaire moleculaire laag door serum IgG van Miller Fisher en verwante syndromen. Neurologie. 1996:47:1317-20.
14. Inoue N, Koh C, Iwahashi T. Detection of serum anticerebellar antibodies in patients with Miller Fisher Syndrome. Euro J Neurol. 1999:42:230-4.
15. Barontini F, Di Lollo S, Maurri s, Lambruschini P. Localization of the pathological process in Miller Fisher Syndrome. Italië J Neurol Sci. 1992:13:221-5.
16. Koga M, Yuki N, Takahashi M, et al. Nauwe associatie van IgA anti-ganglioside antilichamen met antecedente Campylobacter jejuni infectie in Guillain-Barré en Fisher ‘ s syndromen. J Neuroimmunol. 2003:141:112-7.
17. Guiloff RJ. Perifere zenuwgeleiding bij Miller Fisher syndroom. J Neurol Neurochirurg Psychiatr. 1977:40:801-7.
18. Chikakiya H, Kunishige M, Yoshino H, et al. Vertraagde motorische en sensorische neuropathie bij een patiënt met hersenstam encefalitis. J Neurol Sci. 2005:234:105-8.
19. Arakata Y, Yoshimuro M, Kobayashi S, et al. Het gebruik van intraveneuze immunoglobuline bij het syndroom van Miller Fisher. Brain Develop J. 1993: 15:231-3.
20. Matsumoto H, Kobayashi O, Tamura K, et al. Miller Fisher syndroom met voorbijgaande coma: vergelijking met bickerstaff ‘ s hersenstam encefalitis. Brain Develop J. 2002: 24: 98-101.
21. Yeh JH, Chen WH, Chen JR, et al. Miller Fisher syndroom met centrale betrokkenheid: succesvolle behandeling met plasmaferese. Therap Aferesis Dialyse J. 1999: 3: 69-71.
22. Papanikolaou T, Cath G, Boothman B, et al. Case report: acute bilaterale oftalmoparese met pupilaire areflexical mydriasis in Miller-Fisher syndroom behandeld met intraveneuze immunoglobuline. J Ophthalmol. 2010; Artikel-ID 291840.
23. Sandler RD, Hoggard N, Hadjivassiliou M. Miller-Fisher syndroom: Is de ataxie centraal of perifeer? Cerebellum Ataxias. 2015:2:3.
24. Ejma M, Waliszewska-Prosół M, Hofman A, et al. Progressief subacute Miller-fisher syndroom succesvol behandeld met plasmaferese. Poolse J Neurol Neurochirurg. 2015;49(2):137-8.
25. San-Juan OD, Martínez-Herrera JF, Moreno García J, et al. Miller Fisher syndroom: 10 jaar ervaring in een derde niveau centrum. Euro Neurol. 2009; 62: 149-54
26. Snyder LA, Rismondo V, Miller NR. De Fisher-variant van het syndroom van Guillain-Barré (Fisher-syndroom). J Neuroophthalmol. 2009 Dec; 29 (4): 312-24.
27. Ito M, Kuwabara S, Odaka M, et al. Bickerstaff ‘ s hersenstam encefalitis en fisher syndroom vormen een continu spectrum: klinische analyse van 581 gevallen. J Neurol. 2008;255:674-82.
28. Yuki N. Acute parese van extraoculaire spieren geassocieerd met IgG anti-gq1b antilichaam. Ann Neurol 1996; 39: 668-72.