Posts Tagged “Mo theorie; cycloaddition; organische chemie; HOMO; LUMO; geconjugeerd systeem”
een van de meest uitdagende concepten in geconjugeerde systeemreacties is moleculaire orbitale interacties, of MO theorie. De basisprincipes van dit principe kan moeilijk te begrijpen, maar zal zeer informatief in het voorspellen van de juiste reactie Voorwaarden en de uitkomst van de reactie als je ze begrijpt, die u een groot voordeel op toekomstige quizzen en examens zal geven. Wij van StudyOrgo hebben een eenvoudige uitleg van de basics to MO theorie bedacht om je te helpen met je studie voorbereidingen.
principes van de MO-theorie
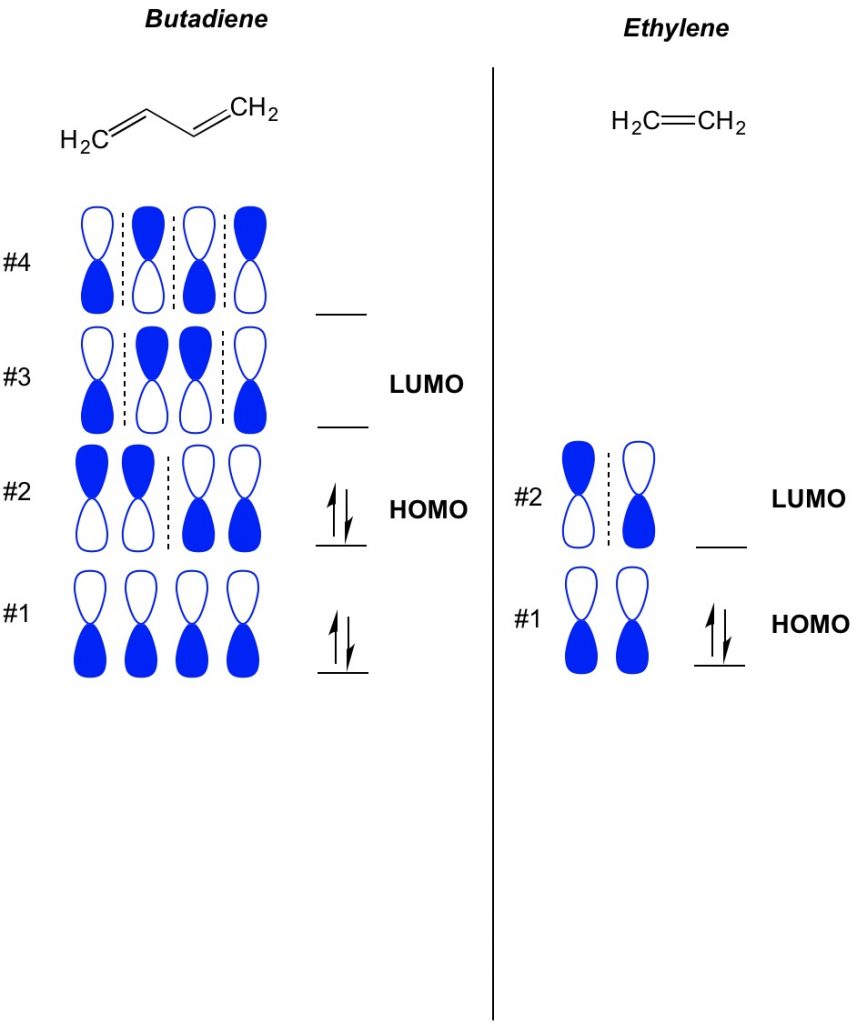
het basisconcept van de mo-theorie is het beschrijven van de afwisselende patronen van orbitalen die bestaan in pi-bindingen. We beschrijven de oriëntatie van elke helft van de halter orbitaal gecentreerd rond een atoom als vet of open. Vergeet niet, er zijn hechting en antibondende orbitalen. In wezen gedragen orbitalen met een lager aantal knooppunten (schakelaars in de oriëntatie van de halter orbitaal die we laten zien met de stippellijn) zich meer als bonding orbitalen terwijl orbitalen met een hoger aantal knooppunten zich gedragen als anti-bonding orbitalen. Om te bepalen welke orbitalen bezet zijn op je molecuul, tel gewoon hoeveel pi bindingen je hebt in je geconjugeerde systeem. Hieronder een voorbeeld van butadieen. Het heeft 4 pi-elektronen, dus vullen we eerst de laagste moleculaire orbitalen, twee in elke orbitaal. Daarom is de hoogst bezette moleculaire orbitaal, of HOMO, in butadieen #2. Als gevolg daarvan is de laagste onbezet moleculaire obital, of LUMO, in butadieen #3. We kunnen dit uitbreiden naar ethyleen en zien dat met 2 pi-elektronen, moleculaire orbitaal # 1 de HOMO is en moleculaire orbitaal #2 de LUMO.
Cycloadditions MO theorie
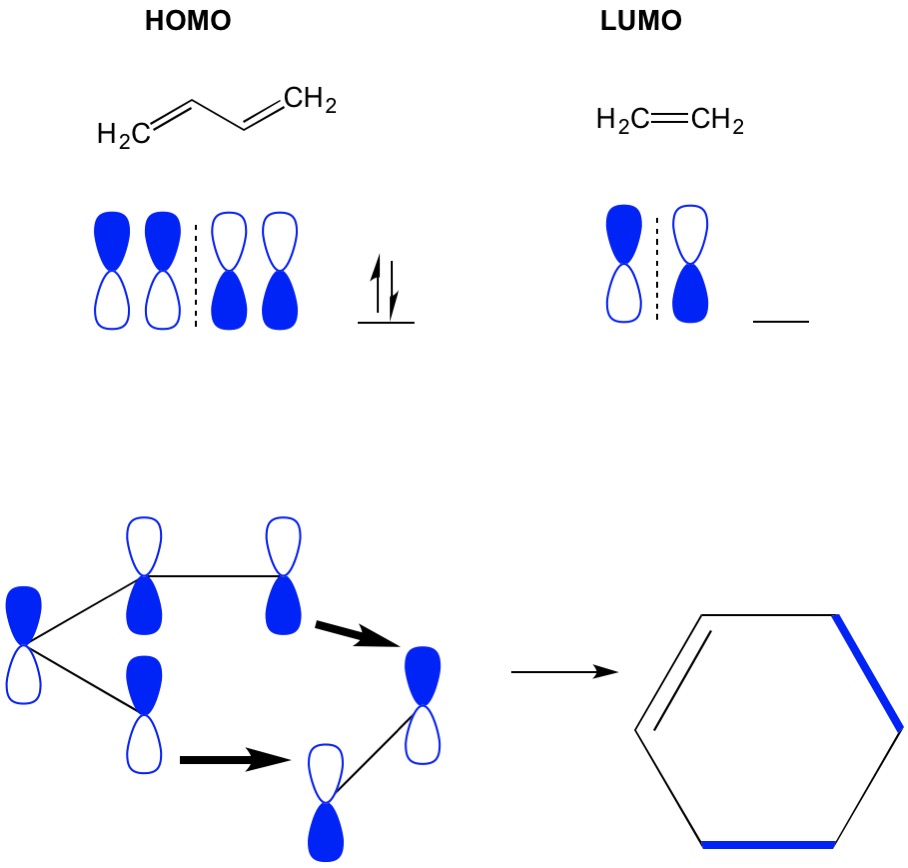
onthoud dat cycloadditiereacties de vorming van nieuwe C-C sigma-bindingen beschrijven door herschikking van de pi-elektronen in een geconjugeerd systeem. Daarom moeten we de moleculaire orbitalen van de pi-elektronen gebruiken om de reactie aan te drijven. Laten we de reactie van butadieen met ethyleen nemen, de meest simplistische Diels Els reactie (4+2 cycloaddition). We beginnen met het meest geconjugeerde molecuul, butadieen en onderzoeken zijn HOMO. Dan kijken we naar het minst geconjugeerde molecuul, ethyleen en onderzoeken zijn LUMO. Waarom? We hebben de elektronen van een HOMO nodig om van het ene molecuul naar het andere te stromen, dus moeten we de LUMO-orbitaal gebruiken die niet bezet is voor dit proces. We zien dat de knooppunten van de HOMO en LUMO uitlijnen; dat is de open en gesloten helften van de halters uitlijnen. Dit leidt tot een voorwaartse reactie en vorming van het product, cyclohexeen.
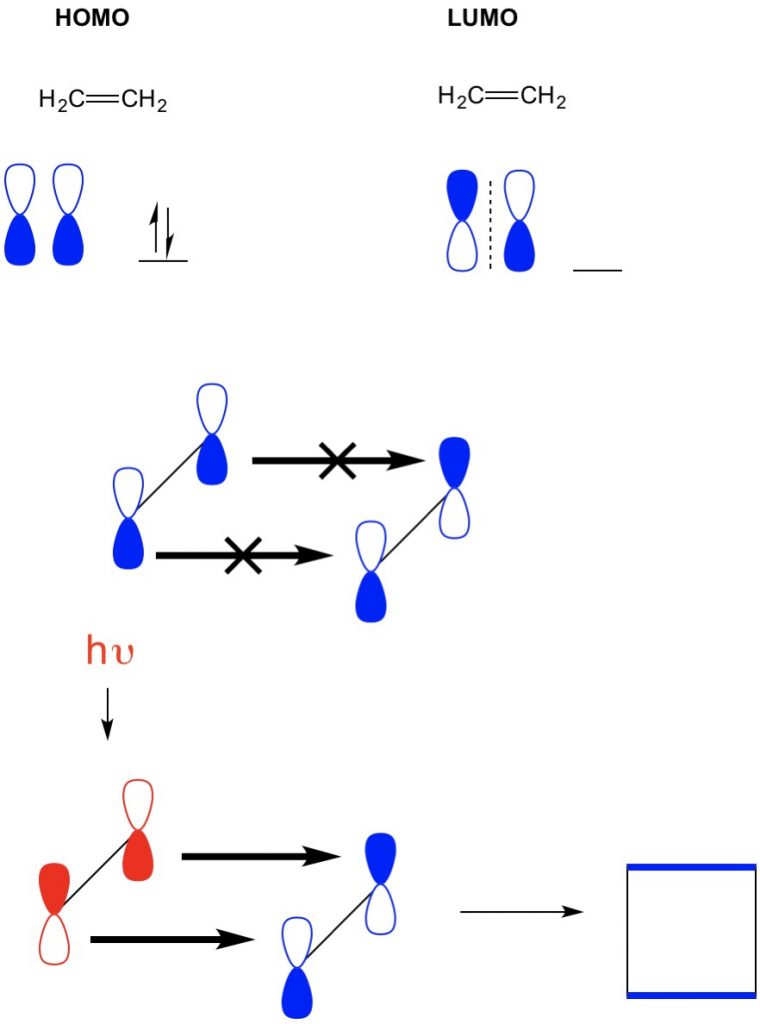
echter, in een ander voorbeeld waar we een (2+2 cycloaddition) hebben, zien we de HOMO en LUMO van ethyleen niet uitlijnen, waardoor de reactie wordt verboden. We hebben echter de mogelijkheid om elektronen van de HOMO naar een hogere baan op te wekken met behulp van licht (hv) of warmte, waardoor de HOMO verandert. We bekijken dit concept in detail in een vorig artikel. Als we dit doen, de HOMO van opgewonden ethyleen en LUMO van gemalen ethyleen lijn en de reactie produceert cyclobutaan.
We hopen dat deze beschrijving deze concepten van de mo-theorie heeft verduidelijkt. Dit is een voorbeeld van de duidelijke en eenvoudige expatiaties die we hebben voorbereid op meer dan 175 reacties die vaak worden gezien in orgo1 en Orgo2 cursussen. Schrijf je vandaag nog in voor je studievoorbereidingsbehoeften!