Low-Tension glaucoom: An Oxymoron in Oftalmology
Ciro Costagliola, MD1; Luca Agnifili, MD, PhD2; Leonardo Mastropasqua, MD2; Alfonso di Costanzo, MD1 (view author affiliations)
voorgestelde citaat voor dit artikel: Costagliola C, Agnifili L, Mastropasqua L, di Costanzo A. Low-Tension glaucoom: An oxymoron in oogheelkunde. Terug Chronische Dis 2019; 16: 180534. DOI: http://dx.doi.org/10.5888/pcd16.180534external pictogram.
De term glaucoom verwijst naar een groep oculaire aandoeningen die gekenmerkt worden door progressieve beschadiging van de oogzenuw en verlies van het gezichtsveld (1). Glaucomateuze oogzenuwlijden zijn te wijten aan het progressieve verlies van retinale ganglioncellen; verhoogde intraoculaire druk (IOD) is een belangrijke risicofactor. IOD kan direct, door een mechanisch effect, of indirect, door de bloedtoevoer beïnvloeden (2). Factoren die de progressie van glaucomateuze oogzenuwlijden beà nvloeden zijn onder meer oudere leeftijd, gevorderd stadium van de ziekte, hogere IOD en schijfbloedingen (3). Bij patiënten met primaire openhoekglaucoom (POAG), is de verhoogde weerstand tegen waterige uitstroom door het trabeculaire netwerk de belangrijkste boosdoener voor verhoogde IOD. Ondanks adequate controle van de IOD, kan glaucomateuze oogzenuwlijden vaak blijven vorderen. Zo worden factoren die geen verband houden met IOD herkend, met als belangrijkste een afname van de bloedtoevoer naar de oogzenuw (4).
andere factoren die geen verband houden met IOD zijn glutamaattoxiciteit, oxidatieve stress, auto-immuniteit en vasculaire dysregulatie (3). Laagspanningsglaucoom (LTG) wordt gedefinieerd als een vorm van glaucoom die POAG nauw nabootst, maar IOD-niveaus zijn binnen het normale bereik en de waarschijnlijke pathogenese is vasculair.
de controversiële vragen zijn 1) is LTG een ziekte in het spectrum van POAG (aan de linkerkant van de verdeling van IOD, op de laagste niveaus)?, 2) is het uiterlijk van de optische schijf secundair aan hypoperfusie van de oogzenuw als gevolg van vaatziekten?, of 3) moet LTG worden opgenomen in een spectrum van aangeboren en verworven optische neuropathieën die glaucomateuze optische neuropathie kunnen simuleren?
Top
is Laagspanningsglaucoom een ziekte in het Spectrum van primair openkamerhoekglaucoom?
toen Albrecht von Graefe in 1857 een vorm van glaucoom beschreef die schade aan de kop van de oogzenuw manifesteerde en een open hoek van de voorste oogkamer, met IOD binnen het referentiebereik, werd Digitale palpatietonometrie beschouwd als de gouden standaard. Als hij een impression tonometer had gebruikt om IOD te meten, zou de grote tekortkoming van de tonometrie zijn geweest dat het zoveel vloeistof verplaatste bij contact met het oog dat de gemeten metingen zeer variabel en onnauwkeurig zouden zijn. Omgekeerd, als hij inkeping tonometrie had gebruikt, zou het niet de verkeerde indeling als gevolg van de aanwezigheid van een dunne centrale hoornvlies hebben overwogen (1). Veel diagnoses van LTG waren voor ogen met dunne hoornvliezen en waren gebaseerd op valse lage waarden voor IOD, een bevinding die twijfels oproept over de diagnose van LTG (5). Bovendien moet de afwezigheid van verhoogde IOD worden gevonden bij metingen die meer dan één keer of overdag worden uitgevoerd, aangezien IOD dag-en nachtfluctuaties laat zien bij gezonde proefpersonen en nog meer bij patiënten met POAG of LTG (6). Voor variaties in IOD kunnen 3 populaties van LTG-patiënten worden onderscheiden: patiënten zonder IOD-fluctuaties, patiënten met dagelijkse IOD-acrofase (de top of piek van een cyclus) en patiënten met nachtelijke IOD-acrofase (7). Patiënten in de laatste 2 categorieën moeten worden beschouwd als echte POAG-patiënten in plaats van LTG-patiënten bij wie glaucomateuze oogzenuwlijden optreden ondanks normale IOD. Het is waarschijnlijk dat patiënten met een dag-of nachtacrofase zijn geïncludeerd in studies gebaseerd op de mechanische theorie; vermindering van IOD kan de progressie van gezichtsveldverlies alleen bij deze patiënten vertragen (8). Gegevens uit het Lagedrukglaucoombehandelingsonderzoek benadrukten de rol van IOD bij de pathogenese van LTG; de progressie van gezichtsveldverlies was verminderd met 9,1% met timolol 0,5% en met 39,1% met brimonidine 0,2% na 2 jaar behandeling (8). In dit onderzoek werden IOD-waarden echter uitsluitend overdag geregistreerd. Daarom is het niet bekend of patiënten met een slechter gezichtsveld nachtelijke IOD-acrofase hadden. Andere studies over asymmetrische LTG rapporteerden dat het oog met hogere IOD Grotere glaucomateuze schade vertoont dan het oog met lagere IOD, die de rol van IOD in de pathogenese ondersteunt (9). Toch werd in al deze klinische studies IOD alleen gemeten tijdens kantooruren; dus werd het gedrag van nachtelijke IOD niet geregistreerd. Een recente studie waarin nychthemeral IOD curves werden geëvalueerd met een telemetrische sensor toonde een nachtelijke acrofase met IOD pieken bij patiënten met LTG, hoewel deze pieken significant lager waren dan de pieken gevonden bij patiënten met POAG (7). In dit onderzoek werd gemeld dat IOD ‘ s nachts een piek bereikte bij 40% tot 80% van de patiënten met normale spanning glaucoom, en het patroon bij deze patiënten was vergelijkbaar met het patroon bij patiënten met POAG. In 24-uurs curven hadden patiënten met LTG en POAG meer uitgesproken IOD-patronen ’s avonds en’ s nachts dan ’s morgens, met meer pieken en grotere IOD-fluctuaties’ s nachts dan ‘ s avonds (7). Andere factoren kunnen de hypothese van een primaire IOP-gerelateerde mechanische spanning in LTG bevestigen, zoals de aanwezigheid van veranderingen in de uitstroomroutes van waterig humor vergelijkbaar met die welke voorkomen in POAG (10).
bij patiënten waarbij LTG kan worden beschouwd als een ziekte in het spectrum van POAG, moeten diagnostische en therapeutische strategieën worden toegepast die vergelijkbaar zijn met die voor patiënten met hyperbaar glaucoom, met behulp van een oogarts (figuur).
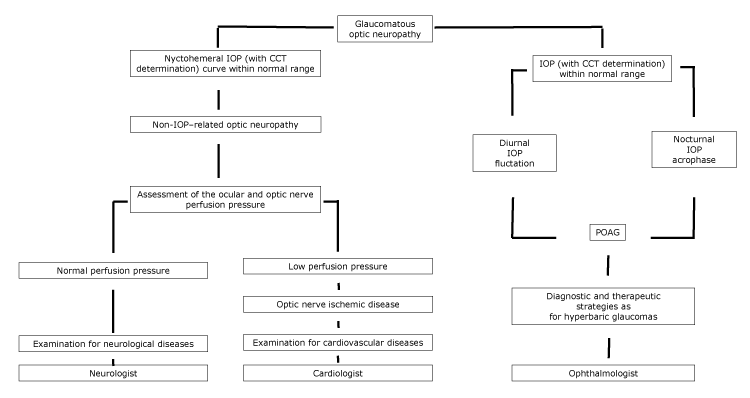
figuur.
voorgesteld stroomschema van oogzenuwlijden, met verwijzing door specialisten, volgens de nychthemerale IOD-kenmerken. Afkortingen: CCT, centrale cornea dikte; IOD, intraoculaire druk; POAG, primaire open-hoek glaucoom.
Top
is het uiterlijk van de optische schijf secundair aan hypoperfusie van de optische zenuw als gevolg van vaatziekten?
bij patiënten met LTG en normale nychthemerale IOD-curven kunnen mechanische factoren niet verantwoordelijk zijn voor oogzenuwlijden; drukonafhankelijke factoren kunnen hierbij betrokken zijn, waarbij vasculaire veranderingen mogelijk de belangrijkste zijn (5). Een glaucomateuze oogzenuwlijden kunnen worden waargenomen bij patiënten met een voorgeschiedenis van een cardiovasculair voorval of met chronische atherosclerose of obstructieve arteriële aandoeningen (11). Bij patiënten met LTG (5) is ook een verminderde bloedstroomsnelheid waargenomen in retrobulbaire slagaders en in de cerebrale circulatie, lage diastolische bloeddruk en een kleinere diameter van het centrale netvlies. Bij deze patiënten is de pathogenese van de ziekte te wijten aan een verminderde oculaire perfusiedruk, voornamelijk gekoppeld aan primaire vasculaire dysregulatie of aan een gegeneraliseerde disfunctie van het endotheliale of autonome zenuwstelsel (5,11). Het is echter onduidelijk of deze factoren de oorzaak of het resultaat van de oogzenuwlijden waren. Vanuit klinisch oogpunt vertoont LTG een hogere incidentie van schijfbloedingen en wordt het vaker geassocieerd met vaatziekten zoals migraine, obstructieve slaapapneu of het syndroom van Raynaud dan met IOD (5). Ten slotte vertoont ongeveer de helft van de LTG-patiënten met pre-perimetrische ziekte schadeprogressie ondanks normale IOD-waarden (12). Al deze bevindingen suggereren de belangrijke rol van vasculaire dysregulatie.
bij patiënten met hart-en vaatziekten kan het zijn dat optic disc cupping niet verder gaat als de onderliggende oorzaak van de oogzenuwlijden onder controle is. Bovendien kunnen LTG-patiënten circumpapillaire atrofie evenals cerebrale corticale micro-infarct vertonen, die tekenen van ischemie zijn (5). Bij patiënten waarbij vaatziekten een hypoperfusie van de oogzenuw veroorzaken, moet een volledig diagnostisch onderzoek naar hart-en vaatziekten worden uitgevoerd, met behulp van een cardioloog (figuur).
Top
moet LTG worden opgenomen in een Spectrum van congenitale en verworven Optische neuropathieën die glaucomateuze optische neuropathie kunnen simuleren?
wanneer de frequentere oorzaken van optic disc cupping zijn uitgesloten, moet de mogelijkheid van een neurodegeneratieve oogzenuwlijden worden overwogen. Deze gevallen zijn de meest frustrerende, omdat optische schijf schade vordert, zelfs nadat IOD is verlaagd. Veel aangeboren en verworven optische neuropathieën zijn opgenomen in deze groep van gevallen, en differentiatie tussen glaucomateuze en niet-laucomateuze cupping kan uitdagend zijn, zelfs voor ervaren waarnemers (13). Onder de aangeboren vormen van optische schijf cupping, megalopapilla, autosomale dominante optische atrofie, en Leber erfelijke optische neuropathie kan produceren een optische schijf uitgraven simuleren glaucomateuze optische neuropathie.
de verworven neuropathieën kunnen secundair zijn aan inflammatoire, compressieve, toxische en traumatische oorzaken. Neuritis optica kan een toename van de cup-to-disc ratio veroorzaken die, hoewel unilateraal, kan worden verward met glaucomateuze oogzenuwlijden. Compressieve laesies, waaronder meningeoom, hypofyse-adenoom, craniofaryngioom en aneurysma van de interne halsslagader, kunnen leiden tot asymmetrische cupping van de optische schijf en ten onrechte toegeschreven aan LTG. Methanol en ethambutol vergiftiging kan een bilaterale optische disc cupping produceren vergelijkbaar met glaucomateuze optische neuropathie, secundair aan axonaal verlies. Wanneer dus een asymmetrisch vergrote beker wordt waargenomen, is verder neuro-oftalmologisch onderzoek noodzakelijk (13).
ten slotte speelt veroudering een belangrijke rol onder de omstandigheden die leiden tot het cuppen van optische schijven. Harju et al vonden dat de mate van optische schijf cupping verhoogd bij gezonde oudere studie deelnemers als gevolg van fysiologisch vezelverlies. Hun onderzoekspopulatie was geschikt en vertegenwoordigde een reeks gezonde ogen zonder glaucoom; gedurende 11 jaar follow-up ontwikkelden de deelnemers aan het onderzoek geen veranderingen in het gezichtsveld en werd geen significante stijging van de IOD geregistreerd (14). In dit laatste geval moet een volledig diagnostisch onderzoek voor neurologische ziekten worden uitgevoerd, met behulp van een neuroloog (figuur).
verbeteringen in diagnostische technieken maken het gemakkelijker dan voorheen om optische schijfcuping te classificeren; een beschrijving van optische schijfkenmerken in combinatie met de beeldvorming van de retinale zenuwvezellaag en optische schijftopografie maakt onderscheid mogelijk tussen glaucomateuze en niet-laucomateuze optische schijfcuping. Bovendien helpt een zorgvuldige analyse van de voorgeschiedenis van de patiënt, samen met morfologische en functionele beoordeling van de oogzenuw, om stoornissen te identificeren.
De term LTG zou een oxymoron kunnen zijn, een nostalgische herinnering aan het verleden toen een gedefinieerde diagnose niet mogelijk was. Het gebruik van de term is als het gebruik van het woord “koorts” wanneer er geen hoge temperatuur of zeggen festina lente (“meer haast, minder snelheid”). De term LTG kan misleidend of onnauwkeurig zijn, omdat het verwijst naar een mechanisch probleem van IOD, terwijl optische schijf cupping en gezichtsveld verlies in ogen met normale intraoculaire druk worden veroorzaakt door andere factoren. Daarom moeten oogartsen in aanwezigheid van optische schijf cupping met normale IOD andere plausibele oorzaken van oogzenuwschade naast intraoculaire druk onderzoeken.
Top
erkenningen
Deze studie ontving geen specifieke subsidie van een financieringsinstelling in de publieke, commerciële of non-profit sectoren.
Top
Auteursinformatie
correspondent: Luca Agnifili, MD, PhD, Oftalmology Clinic, Via dei Vestini, 66100, Chieti (CH), Italië. Telefoon: + 39-0871-358489. E-mail: [email protected].
affiliaties van auteurs: 1departement Of Medicine and Health Sciences, University of Molise, Campobasso, Italy. 2Department Of Medicine and Aging Science, Oftalmology Clinic, University G. d’Annunzio of Chieti-Pescara, Chieti, Italy.
Top
- Coleman AL, Miglior S. Risk factors for glaucoma onset and progression. Surv Ophthalmol 2008;53(6, Suppl):S3–10. CrossRefexternal icon PubMedexternal icon
- Costagliola C, dell’Omo R, Romano MR, Rinaldi M, Zeppa L, Parmeggiani F. Pharmacotherapy of intraocular pressure: part I. Parasympathomimetic, sympathomimetic and sympatholytics. Expert Opin Pharmacother 2009;10(16):2663–77. CrossRefexternal icon PubMedexternal icon
- Weinreb RN, Aung T, Medeiros FA. The pathophysiology and treatment of glaucoma: a review. JAMA 2014;311(18):1901–11. CrossRefexternal icon PubMedexternal icon
- Cherecheanu AP, Garhofer G, Schmidl D, Werkmeister R, Schmetterer L. Ocular perfusion pressure and ocular blood flow in glaucoma. Curr Opin Pharmacol 2013;13(1):36–42. CrossRefexternal icon PubMedexternal icon
- Mastropasqua R, Fasanella V, Agnifili L, Fresina M, Di Staso S, Di Gregorio A, et al. Advance in the pathogenesis and treatment of normal-tension glaucoma. Prog Brain Res 2015;221:213–32. CrossRefexternal icon PubMedexternal icon
- Moon Y, Lee JY, Jeong DW, Kim S, Han S, Kook MS. Relationship between nocturnal intraocular pressure elevation and diurnal intraocular pressure level in normal-tension glaucoma patients. Invest Ophthalmol Vis Sci 2015;56(9):5271–9. CrossRefexternal icon PubMedexternal icon
- Agnifili L, Mastropasqua R, Frezzotti P, Fasanella V, Motolese I, Pedrotti E, et al. Circadian intraocular pressure patterns in healthy subjects, primary open angle and normal tension glaucoma patients with a contact lens sensor. Acta Ophthalmol 2015;93(1):e14-21. CrossRefexternal icon PubMedexternal icon
- De Moraes CG, Liebmann JM, Greenfield DS, Gardiner SK, Ritch R, Krupin T; Low-pressure Glaucoma Treatment Study Group. Risicofactoren voor progressie van het gezichtsveld in het lagedrukglaucoom behandelingsonderzoek. Am J Ophthalmol 2012; 154 (4): 702-11. CrossRefexternal icon PubMedexternal icon
- Cartwright MJ, Anderson Dr.Correlation of asymmetric damage with asymmetric intraocular pressure in normal-tension glaucoom (low-tension glaucoom). Arch Ophthalmol 1988; 106 (7):898-900. CrossRefexternal icon PubMedexternal icon
- Agnifili L, Carpineto P, Fasanella V, Mastropasqua R, Zappacosta A, Di Staso S, et al. Conjunctival findings in hyperbaric and low-tension glaucoma: an in vivo confocal microscopy study. Acta Ophthalmol 2012;90(2):e132–7. CrossRefexternal icon PubMedexternal icon
- Hayreh SS, Jonas JB. Appearance of the optic disk and retinal nerve fiber layer in atherosclerosis and arterial hypertension: an experimental study in rhesus monkeys. Am J Ophthalmol 2000;130(1):91–6. CrossRefexternal icon PubMedexternal icon
- Collaborative Normal-Tension Glaucoma Study Group. Comparison of glaucomatous progression between untreated patients with normal-tension glaucoma and patients with therapeutically reduced intraocular pressures. Am J Ophthalmol 1998;126(4):487–97. CrossRefexternal icon PubMedexternal icon
- Fraser CL, White AJ, Plant GT, Martin KR. Optic nerve cupping and the neuro-ophthalmologist. J Neuroophthalmol 2013;33(4):377–89. PubMedexternal icon
- Harju M, Kurvinen L, Saari J, Vesti E. Change in optic nerve head topography in healthy volunteers: an 11-year follow-up. Br J Ophthalmol 2011;95(6):818–21. CrossRefexternal icon PubMedexternal icon
Top